细胞迁移试验规程
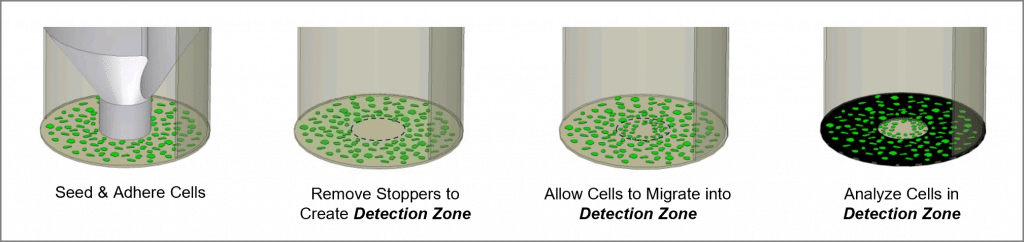
Oris 细胞迁移测定是一种可重复、灵敏、灵活的测定,可用于监测 细胞迁移. 这种检测方法适用于 96 孔板,利用 Oris 医用硅胶制成的细胞播种塞将细胞播种限制在孔的外环形区域。 取下塞子后,每个孔的中心会出现一个直径为 2 毫米的未播种区域,即检测区,播种细胞可移入该区域。 将 Oris 检测掩膜贴在平板底部,将可视范围限制在检测区内,只允许检测已迁移的细胞(见图 1)。 奥利斯细胞迁移分析仪可与任何市售染色或标记技术配合使用。 读数可通过显微镜或微孔板阅读器进行。
可打印的协议文件
- 经组织培养处理的 Oris™ 细胞迁移板(CMA1.101、CMA5.101)
- 涂有胶原 I 的 Oris™ 细胞迁移板(CMACC1.101、CMACC5.101)
- 纤连蛋白涂层 Oris™ 细胞迁移平板(CMAFN1.101、CMAFN5.101)
相关视频 进行细胞迁移试验
所需材料
- Oris 细胞迁移检测试剂盒包括以下内容
- 生物细胞
- 无菌磷酸盐缓冲盐水(PBS)中同时含有钙和镁。++ 和镁++
- 完全细胞培养生长培养基(含血清)
- 无菌移液器吸头/移液器或多通道移液器
- 胰蛋白酶或细胞刮板
- 倒置显微镜(可选)
- 荧光微孔板阅读器(可选)
- 细胞培养标记培养基(无酚红/无血清培养基)
- 细胞标记荧光剂(例如,CellTracker™ Green、Calcein AM)-- - 如果通过微孔板读数器进行检测读数,则需要该读数器。
细胞迁移试验步骤
以下步骤应在生物防护罩内使用无菌技术进行,以防止污染。
- 移除 Oris 细胞迁移分析仪 板材 从冷藏室取出,放在实验台上 1 小时,使其平衡至室温。
- 目视检查 96 孔板的底部,确保 Oris 细胞种植 拦截器 与印版底部紧密密封。 要检查塞子,请将平板翻转过来,检查塞子是否密封(见图 2)。 如果观察到未完全密封,请将平板放回直立位置,然后使用无菌器械将塞子轻轻推回孔中,直到观察到密封为止。
- 注意: 如果将平板倾斜,在间接光源下观察,可以很容易地观察到每个孔底部的 "牛眼 "图案。
- 应用Oris检测 面罩 如果正在收集微孔板阅读器数据,则将检测掩膜置于 96 孔板的底部。 如果采集成像数据,则不需要检测掩膜。
- 将掩膜的倒角与 96 孔板的倒角对齐,确保掩膜的 A1 角与 96 孔板的 A1 孔对齐(见图 3)。
- 将连接片上的孔与 96 孔板底部的凸台对齐。
- 轻轻按压掩膜,直至与 96 孔板底部齐平。
- 注意: 可能需要用乙醇清洗面罩,以去除灰尘和碎屑。 面罩可在检测过程中的任何时候使用。 对于动力学检测,最方便的做法是在孔中放入任何液体之前使用面罩。对于终点检测,最方便的做法是在读取检测结果之前戴上面罩。
- 如果要对细胞迁移进行动力学分析,现在就用荧光染色剂进行预标记。
- 收集细胞,制备密度比最佳播种浓度高 10 倍的悬浮液。
- 首次用户:在进行细胞迁移试验之前,必须确定细胞的最佳播种密度。 有关此过程的讨论,请参阅附录 I。
- 用移液管将 100 µL 悬浮细胞从 Oris 细胞分离瓶的一个侧口移入每个测试孔。
- 注意: 为获得最佳效果,将移液器吸头沿着孔壁(见图 4)添加或提取培养基。 将移液器吸头插入孔中时,应注意不要干扰 Oris 细胞接种塞。 细长吸头或凝胶装载吸头可能有用。
- 重要的是 在工作台上轻轻敲击平板,使孔内容物均匀分布(过度敲击可能导致孔内容物飞溅并造成污染)。
- 将播种板在加湿室中培养 4 至 18 小时(取决于细胞系),以便细胞附着。
- 从培养箱中取出平板。
- 指定几个 "参考 "井,在读取结果之前,塞子将一直放置在这些井中(t=0 迁移前对照)。
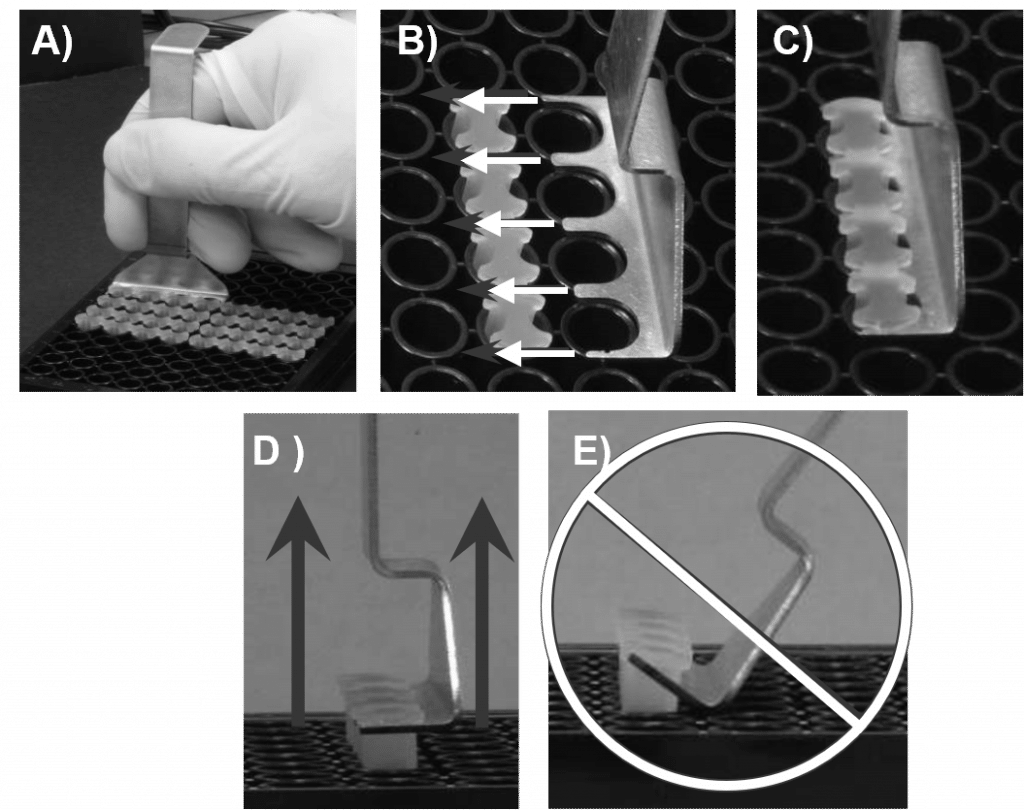
- 使用豪利时塞子工具,取下所有其他塞子(见图 2)。
- 注意: 由于瓶塞工具不是无菌的,因此可能需要用70%乙醇清洗Oris瓶塞工具。
- 将 96 孔板牢牢固定在工作区的平台上。 将 Oris 瓶塞工具的尖头滑入瓶塞条的骨架下,保持瓶塞工具的底部与孔板的上表面齐平。
- 抬起Oris瓶塞工具 纵向 轻轻取下瓶塞。
- 切勿 使用奥利斯塞子工具作为杠杆将塞子从孔中撬出(见图 5E)。这样做可能会导致播种细胞移位并扭曲检测区区域。
- 要移除未附着的细胞,用移液管移除培养基,然后用镊子取出细胞。 轻轻地 用 100 µL 无菌 PBS 或培养基洗孔。 不要使用内部真空吸液。
- 每孔加入 100 µL 新鲜培养基。
- 将平板置于湿化室(37°C,5% CO2) 以允许细胞迁移。可在整个培养期间用显微镜检查细胞,以监测迁移的进展情况。 迁移时间因细胞类型和实验设计而异。
- 如果对细胞迁移进行终点分析,应在细胞充分迁移后用荧光染色剂对细胞进行染色。 有关数据采集和荧光染色技术的更多信息,请参阅第 VI 节和附录 II。
- 注意: Oris 细胞分离瓶塞只能一次性使用;Platypus Technologies 无法保证瓶塞材料在第二次消毒程序后的完整性。
数据采集
Oris 细胞迁移分析仪的读数可在任何时间进行,允许用户进行动力学分析或终点分析。Oris 细胞迁移分析仪可与任何市售的染色或标记技术配合使用。读数可通过显微镜、微孔板阅读器或高内涵成像分析平台进行。
显微镜分析
细胞计数或图像采集/分析软件,如 NIH 图像 J 免费软件。
- 注:可使用相衬显微镜或明场显微镜进行观察。
- 无需将Oris检测面罩固定在Oris平板上。
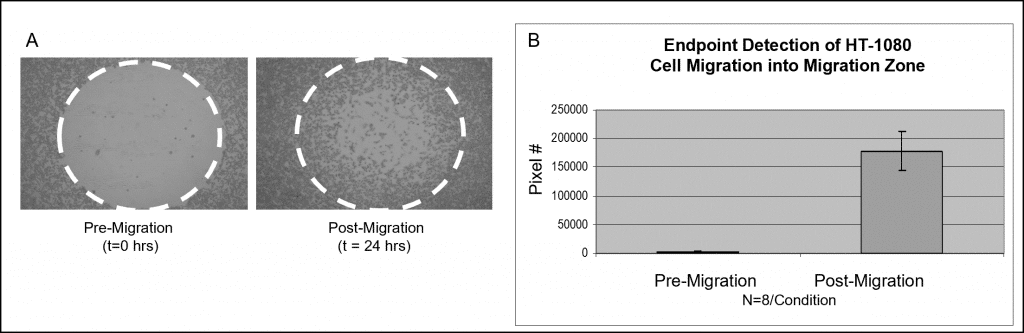
使用比色染色的样本数据如图 3 所示。 将 50,000 个 HT-1080 细胞(即 100 µL 的 5×105 细胞/毫升)并培养过夜。 从测试孔中取出塞子,但在检测读数之前,塞子仍留在迁移前参考孔中。 将播种板在加湿室中培养 24 小时,以允许细胞迁移。从参比孔中取出塞子,固定所有细胞并用 Wright-Giemsa 染色剂处理。使用明视野显微镜采集图像,然后导入 Image J 软件进行阈值分析。下面的图像是在没有检测掩膜的情况下捕获的,说明了迁移前(t=0 小时)和迁移后(t=24 小时)孔的代表性数据(图 6A)。图中描述了每种情况下检测区的平均像素数(图 6B)。
微孔板阅读器分析
- 将 Oris 检测掩膜安装到 Oris 扫描板的底部(请参阅第五部分第 3 步)。
- 最佳设置因微孔板阅读器的品牌和型号而异。请参阅附录 II 和特定仪器的设备用户手册。
- 微孔板阅读器必须设置为从平板底部读取数据。
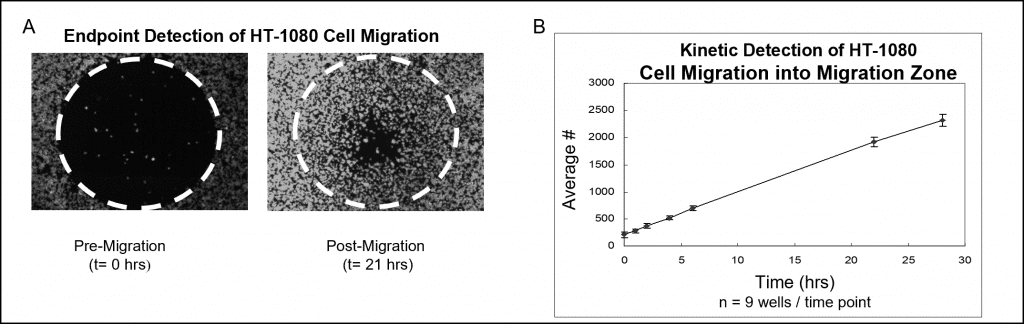
使用荧光染色和微孔板阅读器分析的样本数据如图 7 所示。将 50,000 个 HT-1080 细胞(即 100 μL 的 5×105 细胞/毫升)接种到装有 Oris 细胞接种孔塞的孔中并培养过夜。从测试孔中取出塞子,但塞子仍留在迁移前参考孔中,直到检测读数时才取出。用 CellTracker Green 对细胞进行荧光染色。播种板在加湿室中培养 28 小时,在不同时间点使用平板阅读器测量检测区的荧光信号。下图(图 7A)是在没有检测掩膜的情况下拍摄的,显示了迁移前(t=0 小时)和迁移后(t=21 小时)孔的代表性数据。图 7B 描述了将荧光信号转换为细胞数量的细胞迁移实时分析。
附录 I:确定细胞的最佳浓度
本步骤旨在帮助确定细胞播种密度,以便在使用 Oris™ 细胞迁移试验时使您的细胞系达到汇合。 预期目标是使 Oris™ 细胞播种阻滞器周围的单层达到 90-95% 的融合度,而不会过度生长。
- 建议从以下所示的细胞密度开始评估三个系列稀释液。 放置塞子的孔的细胞播种面积约为 0.3 厘米2. 根据您的特定细胞系的典型播种密度,您可以推断出第一个系列稀释液的不同细胞数,并相应调整下面的数字。
- 制备待测细胞系的对数期培养物。 收集细胞并确定细胞总数。
- 离心沉淀细胞。 准备三个系列稀释液,最终浓度为 1.0 x 106, 0.5 x 106 和 0.25 x 106 细胞/毫升。
- 在 96 孔板中每孔分配 100 µL 细胞悬浮液,形成如下的板布局:
- 第 #1 柱:每孔 100,000 个细胞(8 孔)
- 第 #2 柱:每孔 50,000 个细胞(8 孔)
- 第 #3 柱:每孔 25,000 个细胞(8 孔)
- 将平板置于加湿室(37°C,5% CO2)4-18 个小时(取决于细胞系),同时放置细胞播种塞,使细胞牢固地附着在孔表面。
- 细胞附着后,从每个孔中取出 Oris 细胞播种塞(见图 5),并将其放入培养皿中。 轻轻地 用 PBS 洗孔,去除未附着的细胞。
- 将 96 孔板牢牢固定在工作区的平台上。 将 Oris 瓶塞工具的尖头滑入瓶塞条的骨架下,保持瓶塞工具的底部与孔板的上表面齐平。
- 抬起Oris瓶塞工具 纵向 轻轻取下塞子。 请勿使用 Oris 瓶塞工具作为杠杆从井中撬动瓶塞,否则可能会导致播种细胞移位。
- 在未安装检测掩膜的情况下,使用显微镜目测每个孔,以确定在检测区周边产生汇合单层的最小细胞播种浓度。
至此,您已成功确定了细胞迁移实验步骤 5 中使用的最佳细胞播种浓度。
附录 II:确定微孔板阅读器的最佳设置
本步骤旨在帮助您在使用荧光微孔板阅读器采集 Oris 细胞迁移分析数据时优化仪器设置。
- 使用最佳细胞播种浓度,在预期会导致细胞大量迁移的培养条件下进行细胞迁移试验。 确保包括相同数量的迁移前参照孔(染色前塞不移除)和迁移后测试孔(细胞附着期后移除塞)。 建议每种条件至少包含 8 个测试孔。
- 执行所需的荧光染色技术。Oris 细胞迁移检测试剂盒可与所有类型的荧光染色剂和染色技术配合使用。 使用荧光染色剂对细胞进行染色的精确方法因不同染色剂的性质而异。 使用能均匀染色细胞的荧光试剂对细胞进行染色非常重要。 受实验条件影响的探针会增加结果的变异性,降低荧光信号与细胞迁移之间的相关性。 具体注意事项请咨询荧光染色剂生产商。以下是使用钙黄绿素 AM 进行荧光染色的示例:
- 将 5 μL Calcein AM(1 mg/mL in dry DMSO)与 10 mL 不含酚红、无血清的培养基或 1x PBS(同时含有 Ca2 和 Ca3)混合,对一个完全播种的平板进行染色。++ 和镁++). 稀释后的钙黄绿素 AM 溶液避光保存,直至准备用于步骤 d。
- 小心清除孔中的培养基。
- 用 100 μL PBS(含有钙离子和镁离子)洗孔。++ 和镁++).每孔加入 100 μL 稀释的钙黄绿素 AM 溶液。37°C 孵育 30 - 60 分钟。
- 使用适当的滤光片设置和灵敏度/增益设置,装上掩膜并用微孔板阅读器及时读取。对于 BioTek Synergy™ HT 微孔板阅读器,使用 485/528 纳米激发/发射滤光片,灵敏度 55 纳米。
- 如果尚未安装,则将 Oris 检测掩膜安装到平板上。 使用荧光微孔板阅读器的底部探针,获取各孔的荧光读数。 为优化动态范围,调整仪器增益,使迁移前和迁移后孔之间的荧光信号差异最大化。 有关仪器设置的进一步指导,请参阅微孔板阅读器的仪器手册。
现在您已成功确定了分析细胞迁移的最佳细胞播种浓度和微孔板阅读器设置。
请参阅我们的 常见问题.