常见问题 - 奥利斯细胞迁移试验
与 Boyden 或 transwell 试验相比,Oris 试验提供了更贴近生理的环境,因为没有人工膜供细胞通过。此外,由于没有膜干扰显微镜观察,在 Oris 试验中可以实时监测细胞运动。这不仅能提供更多信息,还能加快方法的开发,因为只需观察试验就能发现终点。
在细胞侵袭方面,Oris 的三维嵌入式侵袭检测法比 Boyden / transwell 检测法更胜一筹,因为在整个检测过程中,细胞都是嵌入在三维环境中,而 Boyden / transwell 检测法是将细胞播种在二维表面上,这就大大改变了细胞的生理机能(如参考文献)。 1,2,3,4,5,6,7,8).
Oris 细胞迁移检测不会损伤细胞,而划痕检测则会损伤细胞。更重要的是,均匀的无细胞检测区提供了比划痕检测更可靠的统计数据,因为 本刊物 和 本应用说明 说明。
如果您想自己给平板镀膜,我们建议您使用 Oris 通用细胞迁移组装套件。这些套件中的平板和塞子是分开包装的。按照您的要求给平板涂上涂层,然后在开始实验前插入塞子。
奥利斯迁移、奥利斯侵袭、奥利斯专业迁移和奥利斯三维包埋侵袭检测法适用于大多数粘附细胞系。非粘附细胞也可用于 Oris 3D 包埋侵袭检测。鸭嘴兽公司已经用 HT-1080、MDA-MB-231、PC3 和 HUVEC 细胞对 Oris 产品进行了多次成功的测试。像您这样的客户还使用过许多其他细胞系的 Oris 产品,作为 谷歌学者 搜索("Oris "和 "细胞迁移")就会发现。
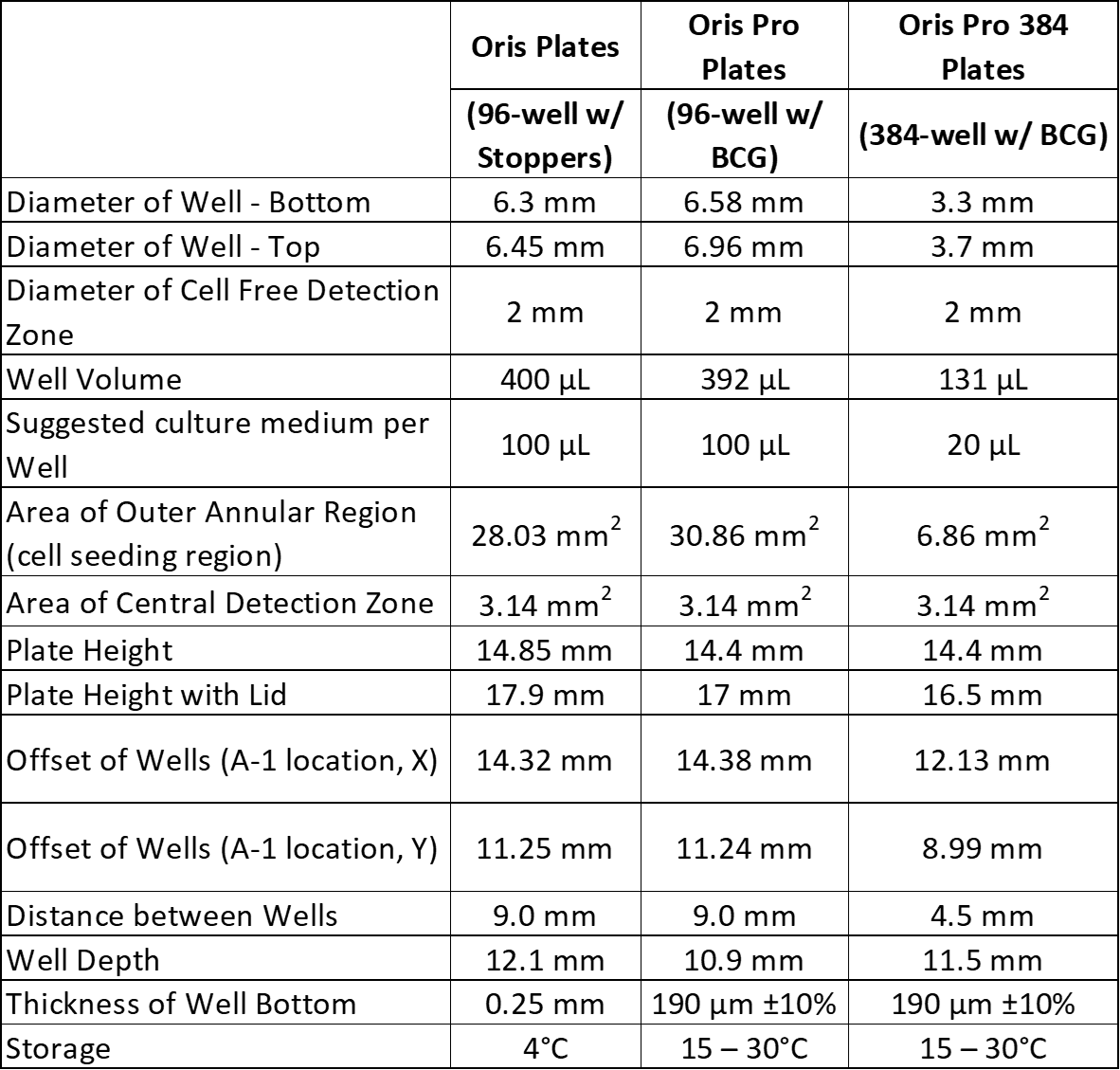
实验开始时,细胞排斥区周围要有 95-100% 融合单层细胞。如果播种密度较高,可能会导致细胞在实验开始时出现在检测区,而如果播种密度较低,则细胞迁移后在检测区出现的迁移细胞较少。通常情况下,Oris 和 Oris Pro 96 孔板每孔播种 20,000 - 75,000 个细胞,Oris Pro 384 孔板每孔播种 2,500 - 10,000 个细胞。对于您的首次实验,我们建议您测试几种不同的细胞播种密度,如《Oris Pro》中附录 1 所述。 检测规程.
对于 Oris 3D 嵌入式侵袭检测,我们建议每孔播种 30,000 - 50,000 个细胞。某些细胞系每孔可播种多达 75,000 个细胞,但许多侵袭性细胞系表达高水平的基质金属蛋白酶,可降解胶原蛋白,使其在高细胞密度下塌陷甚至液化。减少细胞数量可改善这一问题。
为获得最佳统计数据,选择的检测时间应使未处理细胞的闭合面积至少达到检测区原始开放面积的 2/3,但闭合面积应小于 100%。奥利斯细胞迁移和侵袭检测法的一个优点是,您可以在培养期间随时检查实验,以确定细胞移动了多远。第一次进行 Oris 检测时,只需在显微镜下定期观察细胞以评估迁移/侵袭程度,并在观察到适当程度的移动时停止实验。
由于不同细胞类型的细胞移动速度差异很大,因此最佳培养时间也因细胞类型而异。迁移时间为 16 - 72 小时,侵袭时间为 1 - 6 天。若要延长实验时间,我们建议您每 48-72 小时更换一次培养基,并加入新的抑制剂。
奥利斯试剂盒可在单次实验中使用。对于 Oris,瓶塞在使用前必须冷藏保存,以保持完美的结构配合,从而产生可重现的紧密结合的排除区。对于 OrisPro,培养箱中的湿度会使未使用孔中的凝胶水化,这将导致后续实验中排除区大小和凝胶溶解时间的变化。
如果每次实验需要的孔数少于 96 孔,可考虑使用 Oris 细胞迁移组装套件 - FLEX,其中包括 4 个 96 孔板和 4 包 24 个塞子。每个孔板只需使用一次,瓶塞的数量可以是四的倍数。
瓶塞在使用前必须冷藏保存,以保持完美的结构配合,从而产生可重复的、边界紧密的隔离区。如果瓶塞在 37°C 温度下存放时间过长,就会无法正常贴合,从而导致不规则的、可变的禁区。
正确插入的塞子顶端会在孔底部形成牛眼图案。要查看牛眼图案,可在插入塞子后将平板翻转过来并倾斜一定角度。通过透明的底面,您就可以看到每个孔中心的牛眼图案。可以重新插入密封不好的塞子,直到尖端正确放置为止。
虽然 96 孔板是 "行业标准",但不同供应商提供的孔板尺寸各不相同。由于塞子必须完全吻合,才能产生可重复的、边界紧密的禁区,因此只有奥利斯板才能正常工作。
首先将印版牢牢固定在工作台上。然后,将塞子工具的齿滑入塞子条骨干的顶部之间,保持塞子工具的底部与印版的上表面平行。最后,垂直提起塞杆工具,轻轻取下塞杆。切勿将塞子工具用作杠杆从孔中撬出塞子,否则可能会导致细胞移位。此答案是否有用?是 / 否
迁移前/入侵参考井用于确定检测区的大小和位置,以便量化实验井中的移动范围。
对于 Oris 测定仪,您可以在读取结果之前保留一些塞子。由于 Oris Pro 测定仪没有塞子,因此此方法不适用。
对于 Oris Pro 和 Oris 检测,可采用其他方法建立参照井:
只需在迁移即将开始的零时收集图像即可。
在检测开始时将固定液加入复制孔或复制板中。不过,在固定平板中部分孔的细胞时,这种方法有可能会影响邻近固定孔的细胞,因为它们可能会暴露在固定液蒸汽中。
检测开始时,在参照孔中加入迁移或侵袭抑制剂,如细胞松弛素 D。确保加入足够的抑制剂以完全阻止细胞移动。
您可以阅读相关的应用说明 这里。
取下 Oris 瓶塞或溶解 Oris Pro 凝胶后,检测板可能会受到震动。将平板从工作面转移到培养箱时要小心。
细胞系可能没有很好地附着在平板表面。可能的解决办法有
如果您使用的是经 TC 处理的平板,请尝试使用涂有胶原 I 或纤维连接蛋白的平板,以获得更好的粘附性。
如果使用奥利斯检测法,在加入培养基之前,应让细胞有较长的粘附时间。
如果使用 Oris Pro 检测试剂盒,可尝试减少细胞播种体积,使细胞更快到达平板表面。
如果细胞密度较高,可尝试减少细胞播种数量,让所有细胞都有机会粘附。
对于基于塞子的检测,在播种细胞后,取下塞子前,在工作面上轻轻拍打平板,使细胞均匀分布。
对于奥利斯检测法,在细胞附着并取下塞子后,但在迁移开始前,将测试化合物加入培养液中。
对于 Oris Pro 检测试剂盒,在卡介苗溶解、细胞附着后,但在迁移开始前加入检测化合物。
对于 Oris 和 Oris Pro 检测法,附着时间取决于细胞系和平板涂层以及附着时间。在加入测试化合物之前,可以移除并更换培养基,以清除任何不粘附的细胞。在侵袭试验中,可将化合物加入胶原蛋白 I 溶液中和/或加入胶原蛋白上方的培养基中。
有几种选择,首先是最简单的:
检测时间应少于细胞倍增时间,以限制细胞增殖。
2.加入不抑制迁移或侵袭的增殖抑制剂,如放线菌素 D。
用抗 Ki67 抗体(一种只存在于增殖细胞上的标记物)进行免疫染色,并从结果中剔除 Ki67 阳性细胞。
通过视频显微镜监控化验过程,了解每个细胞在化验过程中的变化情况。这种方法耗时且数据量大,需要昂贵的设备。
在明视野光学显微镜下,细胞通常无需染色即可看到,尤其是在有相衬光学显微镜的情况下。然而,染色能使细胞更容易被观察到,并能揭示明视野光学仪器无法揭示的生理状态。奥利斯检测对染色剂的选择没有限制,如果需要,您可以同时使用多种染色剂。
要通过区域闭合对迁移/入侵进行量化,我们建议使用荧光细胞质染色剂,如 TRITC-phalloidin,以最大限度地提高检测器的信号。
要通过计数细胞来量化迁移/入侵,我们建议使用 DAPI 等细胞核染色剂。与细胞质染色剂相比,仅限于细胞核的染色剂可使成像对象更小,单个细胞之间的分离度更高,因此计数也更准确。
您也可以考虑在 Oris 试验中播种细胞前对其进行预标记。不过,有些染色剂可能会影响迁移和/或侵袭,从而可能造成实验假象。