細胞遊走アッセイのプロトコール
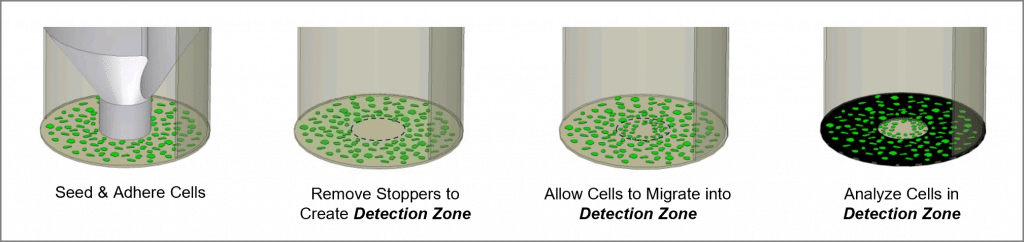
オリスの細胞移動アッセイは、再現性が高く、感度が高く、フレキシブルなアッセイで、以下のようなモニターに使用できます。 細胞移動. 96ウェルプレート用にフォーマットされたこのアッセイ法は、医療用シリコーンで作られたオリスの細胞播種ストッパーを利用して、細胞の播種をウェルの外側の環状領域に制限している。 ストッパーを外すと、各ウェルの中心に直径2mmの播種されていない領域、すなわち検出領域が現れ、そこに播種された細胞が移動する。 オリス検出マスク(Oris Detection Mask)をプレートの底に貼り、検出ゾーンの可視化を制限し、移動した細胞のみを検出できるようにします(図1参照)。 オリスの細胞遊走アッセイは、市販の染色やラベリン グ技術と共に使用できるように設計されています。 読み出しは、顕微鏡またはマイクロプレートリー ダーを用いて行うことができます。
印刷用プロトコル・ファイル
- 組織培養処理オリス™ 細胞移動プレート (CMA1.101, CMA5.101)
- コラーゲン I コーティング オリス™ 細胞移動プレート (CMACC1.101, CMACC5.101)
- フィブロネクチンコーティング オリス™ 細胞移動プレート (CMAFN1.101, CMAFN5.101)
関連ビデオ 細胞遊走アッセイの実施
必要な材料
- オリス セルマイグレーションアッセイキット以下が含まれる:
- オリス セルシーディングストッパー付き96ウェルプレート表面コーティングのオプション
- オリス ディテクションマスク
- オリス ストッパーツール
- 生体細胞
- を含む無菌リン酸緩衝生理食塩水(PBS)。++ およびMg++
- 完全細胞培養増殖培地(血清含有)
- 滅菌ピペットチップ/ピペットまたはマルチチャンネルピペット
- トリプシンまたはセルスクレーパー
- 倒立顕微鏡(オプション)
- 蛍光マイクロプレートリーダー(オプション)
- 細胞培養標識培地(フェノールレッドフリー/血清フリー培地)
- 細胞標識蛍光剤(例:CellTracker™ Green、Calcein AM) - 細胞標識蛍光剤(例:CellTracker™ Green、Calcein AM マイクロプレートリーダーでアッセイを読み出す場合は必要です。
細胞移動アッセイの手順
コンタミネーションを防ぐため、以下の手順は生物学的フード内で無菌操作で行う。
- オリス細胞移動アッセイの除去 プレート 冷蔵から戻し、実験台の上に1時間置いて室温に平衡化させる。
- 96ウェルプレートの下側を目視検査し、Oris® Cell Seeding® が96ウェルプレートの下側にあることを確認する。 ストッパー はプレートの底にしっかりとシールされています。 ストッパーを検査するには、プレートを裏返し、ストッパーが密封されているか調べます(図2参照)。 密封が不完全な場合は、プレートを直立に戻し、滅菌済み器具を用いて、密封が確認できるまでストッパーをウェルにそっと押し戻します。
- 注: プレートを斜めに傾けて間接照明で観察すると、各ウェルの底に「ブルズアイ」パターンがあることがわかる。
- オリスディテクションを適用する マスク マイクロプレートリーダーデータを収集する場合は、96 ウェルプレートの底に Detection Mask を追加します。 画像データを収集する場合は、Detection Maskは必要ありません。
- マスクのA1コーナーがプレートのA1ウェルに合うように、96ウェルプレートの面取りされたコーナーに合わせる(図3参照)。
- アタッチメントラグの穴を96ウェルプレート底部のボスに合わせる。
- 96ウェルプレートの底と同じ高さになるまで、マスクをゆっくりと押し付ける。
- 注: ホコリやゴミを取り除くため、エタノールでマスクを洗浄する必要がある場合があります。 マスクはアッセイ中のどの時点でも装着できます。 キネティックアッセイでは、液体をウェルに入れる前にマスクを装着するのが最も便利です。エンドポイントアッセイでは、アッセイ結果を読み取る直前にマスクを装着するのが最も便利です。
- 細胞遊走の動態解析を行う場合は、蛍光染色で予め標識しておく。
- 細胞を回収し、至適播種濃度の10倍の密度の懸濁液を調製する。
- 初めての方:細胞遊走アッセイを行う前に、細胞の最適播種密度を決定 しなければならない。 このプロセスについては付録Ⅰを参照されたい。
- オリス™ セルシーディングストッパーのサイドポートの一つから、浮遊細胞100 µLを各試験ウェルにピペッティングする。
- 注: 最良の結果を得るには、ピペットチップをウェルの壁に沿わせるようにして、培地を追加または抽出します(図4参照)。 ピペットチップをウェルに挿入する際、オリス セルシーディングストッパーを邪魔しないように注意する 必要があります。 細長いチップやゲルローディングチップが有用です。
- 重要: 作業台の上でプレートを軽く叩き、ウェルの内容物を均等に分散させます(極端に叩くと、ウェルの内容物が飛び散ってコンタミネーションにつながることがあります)。
- 播種したプレートを加湿チャンバー内で4~18時間インキュベートし(細胞株によって異なる)、細胞の接着を可能にする。
- プレートをインキュベーターから取り出す。
- 結果を読み取るまでストッパーが固定されている「参照」ウェルをいくつか指定する(t=0 の移行前コントロール)。
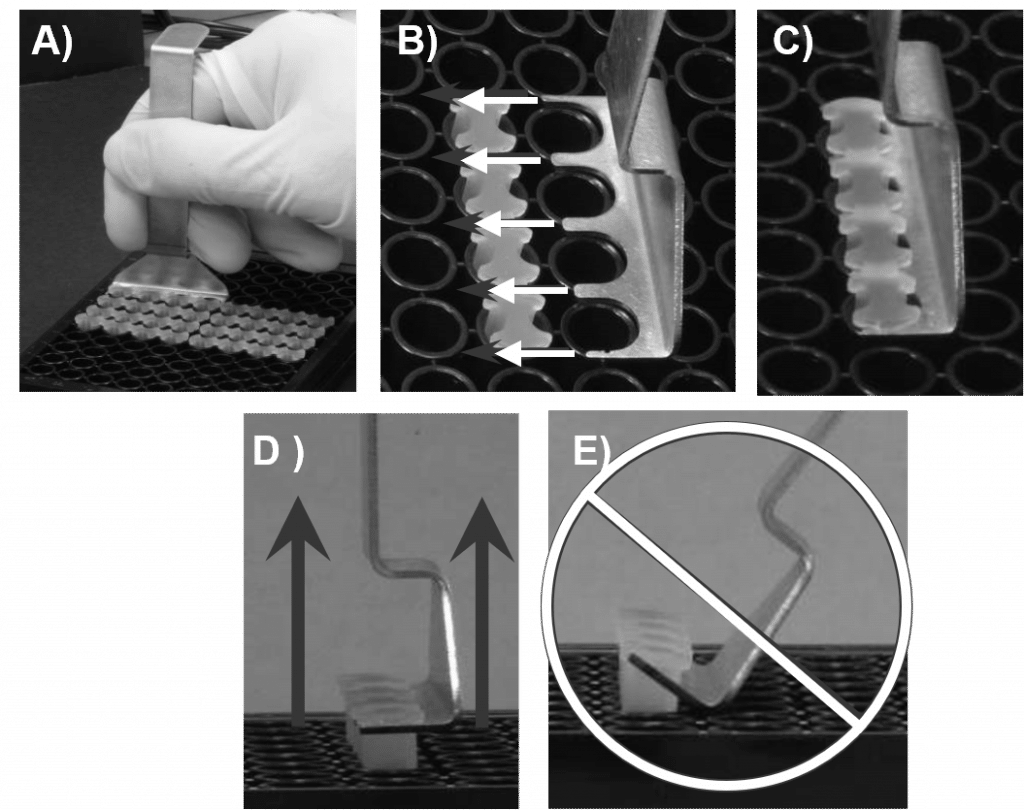
- オリスのストッパーツールを使って、他のストッパーをすべて取り外します(図2参照)。
- 注: ストッパーツールは滅菌されていないため、70%エタノールで洗浄する必要があります。
- 96ウェルプレートをワークスペースのデッキにしっかりと固定します。 オリスストッパーツールの先端をストッパーストリップの骨格の下にスライドさせ、オリスストッパーツールの下面をプレートの上面と同じ高さに保ちます。
- オリス ストッパーツールを持ち上げる 縦に でストッパーをそっと外す。
- 絶対に ウェルからストッパーをこじ開けるために、オリス・ストッパー・ツールをテコのよう に使ってください(図5E参照)。そうする と、播種した細胞がずれたり、検出領域が歪んだりすることがあります。
- 付着していない細胞を除去するには、ピペットで培地を除去し そっと 100μLの滅菌PBSまたは培地でウェルを洗浄する。 真空吸引は行わないでください。
- 新しい培地を各ウェルに100μLずつ加える。
- プレートを加湿チャンバー(37℃、5% CO2)を用いて細胞の遊走を認める。細胞遊走の進行をモニターするために、培養期間中、 細胞を顕微鏡で観察することができる。 遊走時間は、細胞の種類や実験デザインによって異なる。
- 細胞遊走のエンドポイント分析を行う場合は、十分 な遊走が起こった後に蛍光染色で細胞を染色する。 データ取得と蛍光染色技術に関する更なる情報については、セクションVIと付録Ⅱを参照。
- 注: オリス セルシーディングストッパーは1回限りの使用です。プラティパス・テクノロジーズは2回目の滅菌処理後のストッパー素材の完全性を保証することはできません。
データ収集
オリス セルマイグレーションアッセイの読み出しはいつでも行えるので、ユーザーはキネティックアッセイやエンドポイントアッセイを行うことができます。オリス セルマイグレーションアッセイは、市販の染色やラベリン グ技術と併用できるようにデザインされています。読み出しは、顕微鏡、マイクロプレートリーダー、またはハイコンテントイメージング解析プラットフォームを用いて行うことができます。
顕微鏡分析
NIHなどの細胞計数または画像キャプチャ/分析ソフトウェア イメージジェイ フリーウェアが使える。
- 注:位相差顕微鏡または明視野顕微鏡による顕微鏡観察が可能。
- オリスディテクションマスクをオリスのプレートに取り付ける必要はありません。
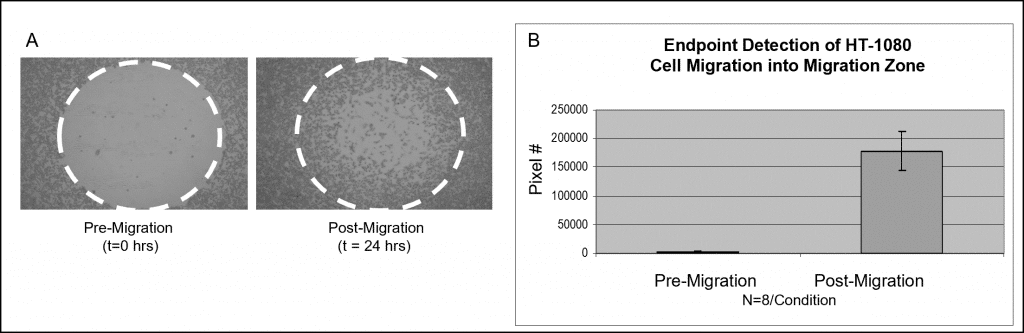
比色染色を用いたサンプルデータを図 3 に示す。 オリスのセルシーディングストッパーを充填したウェルに、50,000 個の HT-1080 細胞を播種した(すなわち、100 µL の 5×105 細胞/mL)を添加し、一晩インキュベートした。 ストッパーはテストウェルから外したが、アッセイ読み出し時まで遊走前リファレンスウェルの定位置に留めた。 播種したプレートを加湿チャンバー内で24時間インキュベートし、細胞の遊走を促した。参照ウェルからストッパーを外し、全細胞を固定し、Wright-Giemsa染色で処理した。明視野顕微鏡で画像を撮影し、Image Jソフトウェアにインポートして閾値処理を用いて解析した。以下の画像は、検出マスクなしで撮影したもので、遊走前(t=0 hrs)と遊走後(t=24 hrs)のウェルの代表的なデータを示している(図6A)。グラフは、各条件における検出ゾーンの平均画素数を示している(図6B)。
マイクロプレートリーダー分析
- オリスディテクションマスクをオリスプレートの底に取り付けます(セクションV、ステップ3を参照)。
- 最適な設定はマイクロプレートリーダーのメーカーやモデルによって異なります。付録Ⅱおよび各装置のユーザーマニュアルを参照してください。
- マイクロプレートリーダーは、プレートの底から読み取るように設定しなければならない。
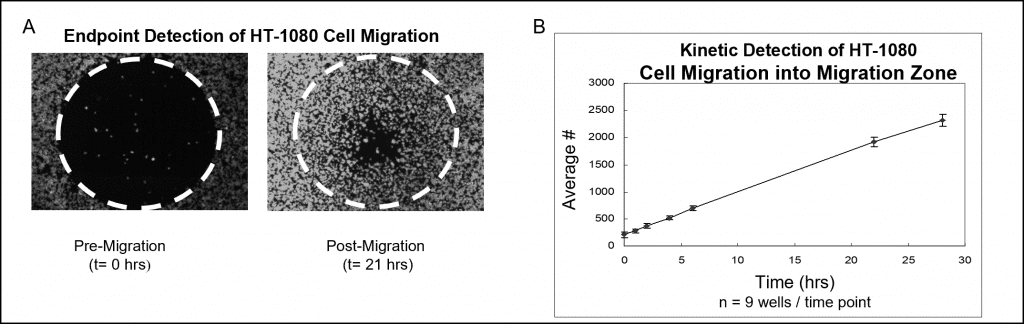
蛍光染色とマイクロプレートリーダー解析を用いたサンプルデータを図 7 に示す。オリスのセルシーディングストッパーを設置したウェルに、HT-1080 細胞を 50,000 個(すなわち 5×105 個/mL を 100 μL)播種し、一晩インキュベートした。ストッパーはテストウェルから取り出したが、アッセイ読み出し時まで遊走前リファレンスウェルにはそのまま留置した。細胞はCellTracker Greenで蛍光染色した。播種したプレートを加湿チャンバー内で28時間インキュベートし、様々な時点で検出ゾーンの蛍光シグナルをプレートリーダーを用いて測定した。下の画像(図7A)は、検出マスクなしで撮影したもので、遊走前(t=0時間)と遊走後(t=21時間)のウェルの代表的なデータを示している。グラフは、蛍光シグナルを細胞数に置き換えて作製した、細胞遊走のリアルタイム解析を示す(図7B)。
付録I:細胞の最適濃度の決定
この手順は、オリス™ セルマイグレーションアッセイを使用する際に、あなたの細胞株のコンフルエントに必要な細胞播種密度を決定する手助けをすることを目的としています。 オリス™ セルシーディングストッパーを取り囲む単層が、過成長することなく 90-95% のコンフルエントになることを目標としています。
- 推奨される開始点は、以下に示す細胞密度で3回連続希釈し て評価することである。 ストッパーを設置したウェルの細胞播種面積は~0.3 cmです。2. あなたの特定の細胞株の典型的な播種密度に基づいて、最初の連続希釈の細胞数を推測し、それに応じて以下の数値を調整することができます。
- 検査する細胞株の対数期培養を準備する。 細胞を回収し、存在する細胞の総数を測定する。
- 遠心分離により細胞をペレット化する。 最終濃度1.0 x 10.0%で3回連続希釈する。6, 0.5 x 106 と0.25 x 106 cells/mLであった。
- ウェル当たり100µLの細胞懸濁液を96ウェルプレートに分注し、以下のプレートレイアウトにする:
- #1カラム:100,000細胞/ウェル(8ウェル)
- カラム#2:50,000細胞/ウェル(8ウェル)
- カラム#3:25,000細胞/ウェル(8ウェル)
- プレートを加湿チャンバー(37℃、5% CO2)で4~18時間(細胞株によって異なる)、細胞播種ストッパーを設置し、細胞がウェル表面にしっかりと接着するようにした。
- 細胞接着後、各ウェルからオリスのセルシーディングストッパーを取り外 します(図5参照)。 そっと ウェルをPBSで洗浄し、付着していない細胞を除去する。
- 96ウェルプレートをワークスペースのデッキにしっかりと固定します。 オリスストッパーツールの先端をストッパーストリップの骨格の下にスライドさせ、オリスストッパーツールの下面をプレートの上面と同じ高さに保ちます。
- オリス ストッパーツールを持ち上げる 縦に でストッパーを静かに外します。 ストッパーをウェルからこじ開けるレバーとしてオリスストッパーツールを使用しないでください。
- 検出マスク(Detection Mask)を装着せずに、顕微鏡を用いて各ウェルを目視検査し、検出ゾーンの周囲にコンフルエントな単層を形成する最小細胞播種濃度を決定する。
この時点で、細胞遊走アッセイプロトコルのステップ 5 で使用する最適な細胞播種濃度が決定されました。
付録 II: マイクロプレートリーダーの最適設定の決定
この手順は、蛍光マイクロプレートリーダーを使用し てオリス細胞遊走アッセイのデータを取り込む際に、装置の 設定を最適化することを目的としたものです。
- 最適な細胞播種濃度を用い、確実な細胞遊走が期待される 培養条件を用いて細胞遊走アッセイを行います。 必ず同数の遊走前リファレンスウェル(染色までストッパーをそのままにしておく)と遊走後テストウェル(細胞接着期間後にストッパーを外す)を含める。 各条件につき最低8ウェルが推奨されます。
- 目的の蛍光染色法を行う。オリスCell Migration Assayはあらゆるタイプの蛍光染色と染色技術に対応するようにデザインされています。 蛍光染色で細胞を染色する正確な方法は、個々の染 色の性質によって異なります。 細胞を均一に染色する蛍光試薬を用いて染色することが重要である。 実験条件の影響を受けるプローブは、結果のばらつきを大きくし、蛍光シグナルと細胞遊走の相関性を低下させる。 具体的な注意点については、蛍光染色のメーカーにご相談ください。以下はCalcein AMを用いた蛍光染色プロトコルの例である:
- 完全に播種したプレート1枚を染色するには、5μLのカルセインAM(乾燥DMSO中1mg/mL)を、10mLのフェノールレッド無添加培地および無血清培地、または1x PBS(Ca++ およびMg++). ステップdで使用するまで、希釈したCalcein AM溶液を光から保護する。
- ウェルから培地を注意深く取り除く。
- 100μLのPBS(Caを含む)でウェルを洗浄する。++ およびMg++).希釈したCalcein AM溶液100μLを各ウェルに加える。プレートを37℃で30~60分間インキュベートする。
- マスクを取り付け、適切なフィルターセットと感度/ゲイン設定を用いてマイクロプレートリーダーで速やかに読み取る。BioTek Synergy™ HT マイクロプレートリーダーでは、485/528 nm の励起/発光フィルター、感度 55 nm を使用する。
- まだ装着されていない場合は、Oris Detection Maskをプレートに貼り付けます。 蛍光マイクロプレートリーダーのボトムプローブを用いて、各ウェルの蛍光を読み取る。 ダイナミックレンジを最適化するために、マイグレーション前とマイグレーション後のウェル間の蛍光シグナルの差が最大になるように装置のゲインを調整する。 装置の設定に関する詳しいガイダ ンスについては、ご使用のマイクロプレートリーダーの装置マニュアルを参照してください。
これで、細胞遊走の分析に最適な細胞播種濃度とマイクロプレートリー ダー設定を決定することができました。
その他のヒントは よくある質問.