세포 이동 분석 프로토콜
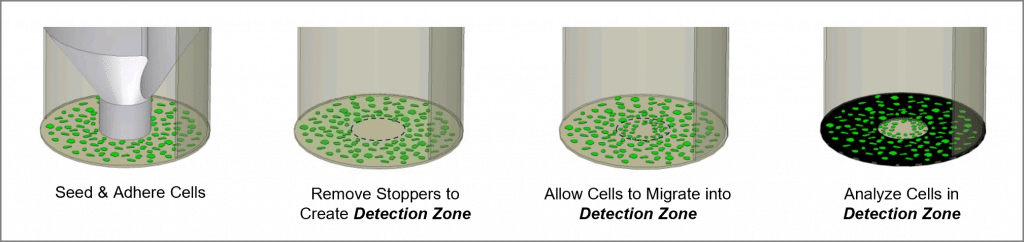
Oris 세포 이동 분석은 다음을 모니터링하는 데 사용할 수 있는 재현 가능하고 민감하며 유연한 분석법입니다. 세포 이동. 96웰 플레이트용으로 포맷된 이 분석은 의료용 실리콘으로 제작된 Oris 세포 시딩 스토퍼를 사용하여 웰의 바깥쪽 환형 영역으로 세포 시딩을 제한합니다. 스토퍼를 제거하면 각 웰의 중앙에 직경 2mm의 시딩되지 않은 영역, 즉 검출 영역이 나타나며, 이 영역으로 시딩된 세포가 이동할 수 있습니다. Oris 검출 마스크는 플레이트 바닥에 적용되어 시각화를 검출 영역으로 제한하여 이동한 세포만 검출할 수 있도록 합니다(그림 1 참조). Oris 세포 이동 분석은 시판되는 모든 염색 또는 라벨링 기법과 함께 사용할 수 있도록 설계되었습니다. 판독은 현미경 또는 마이크로 플레이트 판독기를 사용하여 수행할 수 있습니다.
인쇄 가능한 프로토콜 파일
- 조직 배양 처리된 Oris™ 세포 이동 플레이트(CMA1.101, CMA5.101)
- 콜라겐 I 코팅 Oris™ 세포 이동 플레이트(CMACC1.101, CMACC5.101)
- 피브로넥틴 코팅 오리스™ 세포 이동 플레이트(CMAFN1.101, CMAFN5.101)
관련 동영상: 세포 이동 분석 수행
필요한 자료
- Oris 세포 이동 분석 키트에는 다음이 포함됩니다:
- 생물학적 세포
- Ca가 모두 포함된 멸균 인산 완충 식염수(PBS)++ 및 Mg++
- 완전한 세포 배양 성장 배지(혈청 포함)
- 멸균 파이펫 팁/파이펫 또는 다중 채널 파이펫
- 트립신 또는 세포 스크레이퍼
- 인버티드 현미경(옵션)
- 형광 마이크로 플레이트 리더기(옵션)
- 세포 배양 라벨링 배지(페놀 레드 무첨가/혈청 무첨가 배지)
- 세포 라벨링 형광 제제(예: CellTracker™ 그린, 칼세인 AM) - - - 마이크로 플레이트 리더기를 통해 분석 판독을 수행하는 경우 필요합니다.
세포 이동 분석 절차
다음 단계는 오염을 방지하기 위해 무균 기술을 사용하여 생물학적 후드에서 수행해야 합니다.
- Oris 세포 이동 분석 제거 플레이트 를 냉장실에서 꺼내 실험실 벤치에 1시간 동안 놓아 실온과 평형을 이룰 수 있도록 합니다.
- 96웰 플레이트의 아래쪽을 육안으로 검사하여 Oris 세포 시딩이 제대로 이루어졌는지 확인합니다. 스토퍼 가 접시 바닥에 단단히 밀봉되어 있는지 확인합니다. 스토퍼를 검사하려면 플레이트를 뒤집어 스토퍼가 잘 밀봉되었는지 검사합니다(그림 2 참조). 불완전 밀봉이 관찰되면 플레이트를 똑바로 세우고 멸균 기구를 사용하여 밀봉이 관찰될 때까지 스토퍼를 웰에 부드럽게 다시 밀어 넣습니다.
- 참고: 플레이트를 비스듬히 기울여 간접 조명 아래에서 보면 각 웰 바닥의 "불스아이" 패턴이 드러나기 때문에 스토퍼의 밀봉 상태를 쉽게 관찰할 수 있습니다.
- Oris 탐지 적용 마스크 를 96웰 플레이트 하단에 부착합니다(마이크로 플레이트 리더 데이터를 수집하는 경우). 이미징 데이터를 수집하는 경우 감지 마스크는 필요하지 않습니다.
- 마스크의 모따기 모서리를 96웰 플레이트의 모서리에 맞춰 마스크의 A1 모서리가 플레이트의 A1 웰과 정렬되도록 합니다(그림 3 참조).
- 부착 러그의 구멍을 96웰 플레이트 하단의 보스와 정렬합니다.
- 마스크가 96웰 플레이트의 바닥과 수평이 될 때까지 부드럽게 누릅니다.
- 참고: 먼지와 이물질을 제거하기 위해 마스크를 에탄올로 세척해야 할 수도 있습니다. 마스크는 분석 중 언제든지 착용할 수 있습니다. 동역학 분석의 경우 액체를 웰에 넣기 전에 마스크를 적용하는 것이 가장 편리합니다. 엔드포인트 분석의 경우, 분석 결과를 읽기 직전에 마스크를 적용하는 것이 가장 편리합니다.
- 세포 이동에 대한 동역학 분석을 수행하는 경우, 지금 형광 염색으로 미리 라벨을 지정하세요.
- 세포를 채취하고 최적의 파종 농도보다 10배 더 높은 농도의 현탁액을 준비합니다.
- 처음 사용자: 세포 이동 분석을 수행하기 전에 세포의 최적 시딩 밀도를 결정해야 합니다. 이 프로세스에 대한 설명은 부록 I을 참조하세요.
- 현탁된 세포 100µL를 Oris 세포 시딩 스토퍼의 측면 포트 중 하나를 통해 각 테스트 웰에 피펫팅합니다.
- 참고: 최상의 결과를 얻으려면 파이펫 팁을 웰의 벽을 따라 배치하여 배지를 추가하거나 추출하십시오(그림 4 참조). 파이펫 팁을 웰에 넣을 때 Oris Cell Seeding 마개가 손상되지 않도록 주의해야 합니다. 가늘고 긴 팁이나 젤 로딩 팁이 유용할 수 있습니다.
- 중요: 작업 표면에 접시를 가볍게 두드려 우물 내용물이 고르게 분포되도록 합니다(세게 두드리면 우물 내용물이 튀어 오염될 수 있습니다).
- 세포가 부착될 수 있도록 4~18시간(세포주에 따라 다름) 동안 가습 챔버에서 시드된 플레이트를 배양합니다.
- 인큐베이터에서 플레이트를 제거합니다.
- 결과를 읽을 때까지 스토퍼가 제자리에 유지될 여러 개의 '참조' 웰을 지정합니다(t=0 사전 마이그레이션 제어).
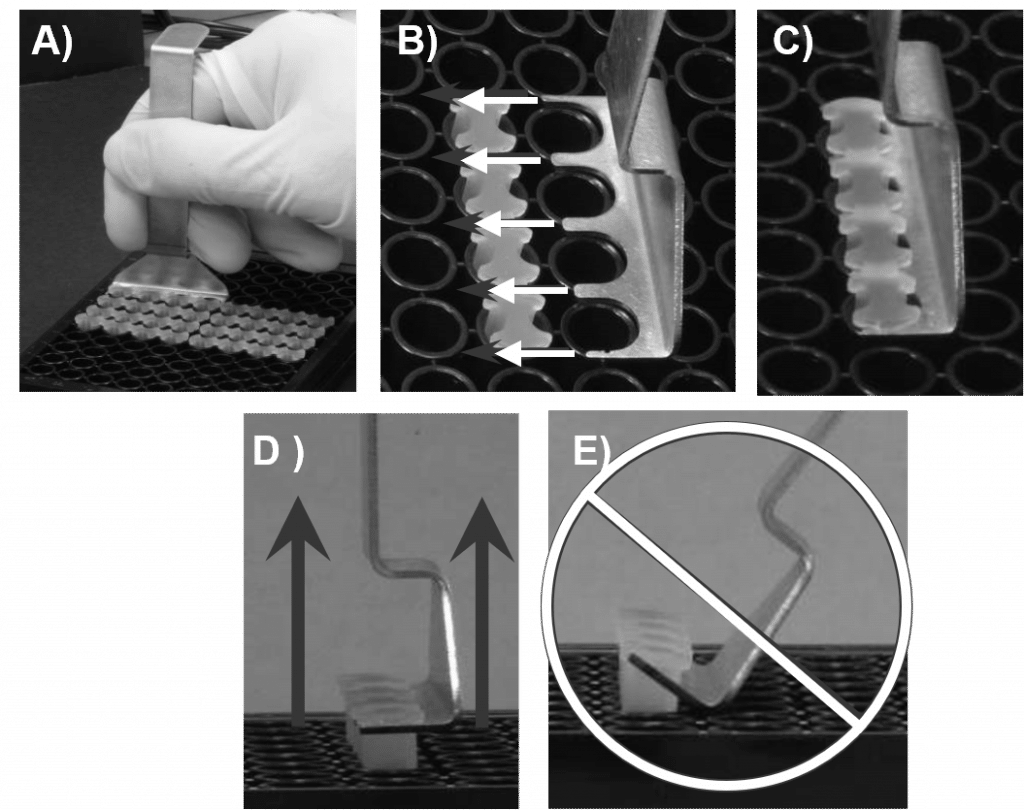
- Oris 스토퍼 도구를 사용하여 다른 모든 스토퍼를 제거합니다(그림 2 참조).
- 참고: 스토퍼 도구는 멸균되지 않으므로 70% 에탄올로 Oris 스토퍼 도구를 세척해야 할 수도 있습니다.
- 96웰 플레이트를 작업 공간의 데크에 단단히 고정하여 고정합니다. Oris 마개 도구의 틴을 마개 스트립의 백본 아래로 밀어 넣어 Oris 마개 도구의 아래쪽이 플레이트의 윗면과 수평을 이루도록 합니다.
- Oris 스토퍼 도구 들어올리기 세로로 를 눌러 마개를 부드럽게 제거합니다.
- 하지 마세요 Oris 스토퍼 도구를 지렛대로 사용하여 웰에서 스토퍼를 들어 올립니다(그림 5E 참조). 이렇게 하면 시드된 세포가 변위되어 감지 영역 영역이 왜곡될 수 있습니다.
- 부착되지 않은 세포를 제거하려면 피펫으로 배지를 제거하고 부드럽게 100µL의 멸균 PBS 또는 배지로 웰을 세척합니다. 사내 진공기를 사용하여 흡인하지 마세요.
- 각 웰에 100µL의 신선한 배양액을 추가합니다.
- 가습 챔버에서 배양 접시(37°C, 5% CO2)를 사용하여 세포 이동을 허용합니다. 배양 기간 동안 세포를 현미경으로 검사하여 이동의 진행 상황을 모니터링할 수 있습니다. 이동 시간은 세포 유형과 실험 설계에 따라 달라질 수 있습니다.
- 세포 이동에 대한 엔드포인트 분석을 수행하는 경우, 충분한 이동이 발생한 후 형광 염색으로 세포를 염색합니다. 데이터 수집 및 형광 염색 기법에 대한 자세한 내용은 섹션 VI 및 부록 II를 참조하세요.
- 참고: 오리스의 세포 시딩 스토퍼는 일회용이며, 플라티퍼스 테크놀로지스는 2차 멸균 절차 후 스토퍼 재료의 무결성을 보장할 수 없습니다.
데이터 수집
Oris 세포 이동 분석의 판독은 언제든지 수행할 수 있으므로 사용자는 동역학 분석 또는 엔드포인트 분석을 수행할 수 있습니다. Oris 세포 이동 분석은 시판되는 모든 염색 또는 라벨링 기법과 함께 사용할 수 있도록 설계되었습니다. 판독은 현미경, 마이크로 플레이트 판독기 또는 고함량 이미징 분석 플랫폼을 사용하여 수행할 수 있습니다.
현미경 분석
세포 계수 또는 이미지 캡처/분석 소프트웨어(예: NIH) ImageJ 프리웨어를 사용할 수 있습니다.
- 참고: 위상차 또는 밝은 필드 현미경을 사용하여 현미경 관찰이 가능합니다.
- Oris 감지 마스크를 Oris 플레이트에 부착할 필요가 없습니다.
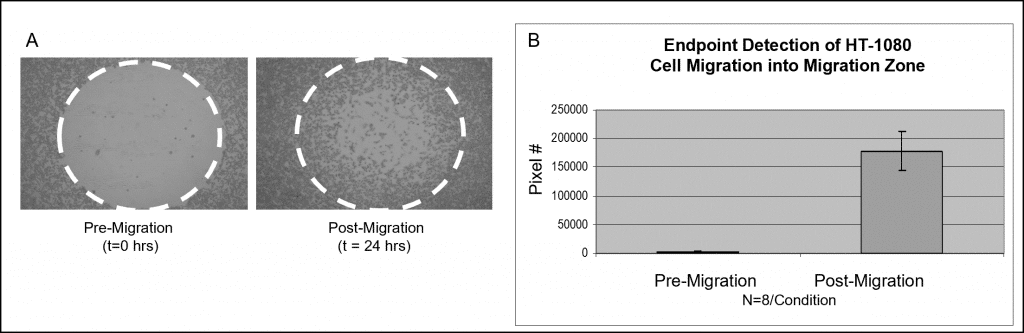
비색 염색을 사용한 샘플 데이터는 그림 3에 나와 있습니다. Oris 세포 시딩 스토퍼로 채워진 웰에 50,000개의 HT-1080 세포를 시딩했습니다(즉, 5×10의 100µL5 세포/mL)를 넣고 밤새 배양했습니다. 스토퍼는 테스트 웰에서 제거되었지만 분석 판독 시점까지 이동 전 기준 웰에 그대로 유지되었습니다. 시드된 플레이트는 세포 이동을 허용하기 위해 가습 챔버에서 24시간 동안 배양되었습니다. 기준 웰에서 스토퍼를 제거하고 모든 세포를 고정하고 라이트-기엠사 염색으로 처리했습니다. 이미지를 공초점 현미경으로 캡처한 다음 Image J 소프트웨어로 가져와 임계값을 사용하여 분석했습니다. 아래 이미지는 검출 마스크를 사용하지 않고 캡처한 것으로, 이동 전(t=0시간) 및 이동 후(t=24시간) 웰의 대표적 데이터를 보여줍니다(그림 6A). 그래프는 각 조건에 대한 감지 영역의 평균 픽셀 수를 나타냅니다(그림 6B).
마이크로 플레이트 리더기 분석
- Oris 감지 마스크를 Oris 플레이트 하단에 부착합니다(섹션 V, 3단계 참조).
- 최적의 설정은 마이크로 플레이트 판독기 제조사 및 모델에 따라 다릅니다. 부록 II 및 특정 기기에 대한 장비 사용 설명서를 참조하세요.
- 마이크로 플레이트 리더는 플레이트 하단에서 판독하도록 설정해야 합니다.
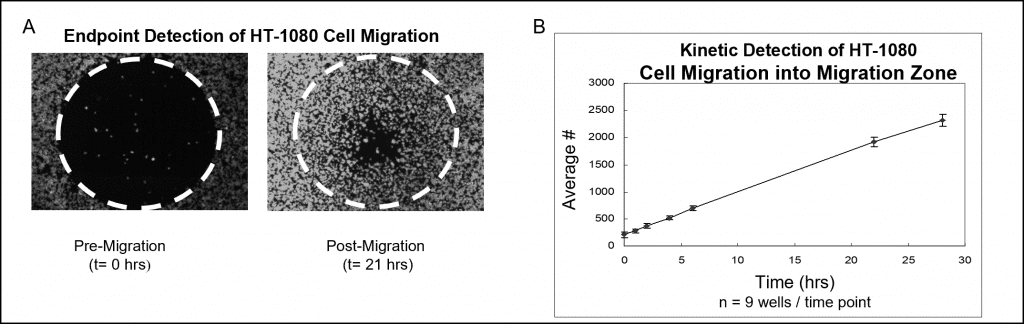
형광 염색 및 마이크로플레이트 판독기 분석을 사용한 샘플 데이터는 그림 7에 나와 있습니다. Oris 세포 시딩 스토퍼로 채워진 웰에 50,000개의 HT-1080 세포(즉, 5×105 세포/mL의 100μL)를 시딩하고 하룻밤 동안 배양했습니다. 스토퍼는 테스트 웰에서 제거되었지만 분석 판독 시점까지 이동 전 기준 웰에 그대로 유지되었습니다. 세포를 CellTracker Green으로 형광 염색했습니다. 시드된 플레이트는 가습 챔버에서 28시간 동안 배양되었고 다양한 시점에 플레이트 판독기를 사용하여 검출 영역의 형광 신호를 측정했습니다. 아래 이미지(그림 7A)는 검출 마스크를 사용하지 않고 캡처한 것으로, 이동 전(t=0시간) 및 이동 후(t = 21시간) 웰의 대표적인 데이터를 보여줍니다. 그래프는 형광 신호를 세포 수로 변환하여 준비한 세포 이동의 실시간 분석을 보여줍니다(그림 7B).
부록 I: 최적의 세포 농도 결정하기
이 절차는 Oris™ 세포 이동 분석법을 사용할 때 세포주의 합류에 필요한 세포 시딩 밀도를 결정하는 데 도움을 주기 위한 것입니다. 의도된 목표는 Oris™ 세포 시딩 스토퍼를 둘러싼 단층이 과도하게 성장하지 않고 90-95% 합류에 도달하는 것입니다.
- 아래 표시된 세포 밀도에서 세 가지 연속 희석을 평가하는 것이 좋습니다. 스토퍼가 제자리에 있는 웰의 세포 시딩 영역은 약 0.3cm입니다.2. 특정 세포주의 일반적인 시드 밀도에 따라 첫 번째 직렬 희석에 대해 다른 세포 번호를 유추하고 그에 따라 아래 숫자를 조정할 수 있습니다.
- 테스트할 세포주의 로그상 배양을 준비합니다. 세포를 수집하고 존재하는 총 세포 수를 확인합니다.
- 원심분리하여 펠렛 세포를 분리합니다. 최종 농도 1.0 x 10의 세 가지 연속 희석액을 준비합니다.6, 0.5 x 106 및 0.25 x 106 세포/mL.
- 웰당 100µL의 세포 현탁액을 96웰 플레이트에 분주하여 다음과 같은 플레이트 레이아웃을 만듭니다:
- 컬럼 #1: 웰당 100,000세포(8웰)
- 컬럼 #2: 웰당 50,000세포(8웰)
- 컬럼 #3: 웰당 25,000세포(8웰)
- 접시를 가습 챔버(37°C, 5% CO2)에 4~18시간(세포주에 따라 다름) 동안 세포 시딩 스토퍼를 사용하여 세포가 웰 표면에 단단히 부착될 수 있도록 합니다.
- 세포 부착 후, 각 웰에서 Oris 세포 시딩 스토퍼를 제거합니다(그림 5 참조). 부드럽게 웰을 PBS로 세척하여 부착되지 않은 세포를 제거합니다.
- 96웰 플레이트를 작업 공간의 데크에 단단히 고정하여 고정합니다. Oris 마개 도구의 틴을 마개 스트립의 백본 아래로 밀어 넣어 Oris 마개 도구의 아래쪽이 플레이트의 윗면과 수평을 이루도록 합니다.
- Oris 스토퍼 도구 들어올리기 세로로 를 사용하여 스토퍼를 부드럽게 제거합니다. Oris 스토퍼 도구를 지렛대로 사용하여 웰에서 스토퍼를 들어올리면 시드된 세포가 변위될 수 있으므로 사용하지 마십시오.
- 검출 마스크를 사용하지 않은 상태에서 현미경을 사용하여 각 웰을 육안으로 검사하여 검출 영역의 경계에서 합류하는 단층을 생성하는 최소 세포 시딩 농도를 결정합니다.
이 시점에서 세포 이동 분석 프로토콜의 5단계에서 사용할 최적의 세포 시딩 농도를 성공적으로 결정했습니다.
부록 II: 마이크로 플레이트 판독기를 위한 최적의 설정 결정하기
이 절차는 형광 마이크로플레이트 판독기를 사용하여 Oris 세포 이동 분석에서 데이터를 캡처할 때 기기의 설정을 최적화하는 데 도움을 주기 위한 것입니다.
- 최적의 세포 시딩 농도를 사용하여 강력한 세포 이동이 예상되는 배양 조건을 사용하여 세포 이동 분석을 수행합니다. 동일한 수의 이동 전 기준 웰(염색할 때까지 스토퍼를 그대로 둔 상태)과 이동 후 테스트 웰(세포 부착 기간 후 스토퍼를 제거한 상태)을 포함해야 합니다. 조건당 최소 8개 웰을 사용하는 것이 좋습니다.
- 원하는 형광 염색 기법을 수행합니다. Oris 세포 이동 분석은 모든 유형의 형광 염색 및 염색 기법과 함께 작동하도록 설계되었습니다. 형광 염색으로 세포를 염색하는 정확한 방법은 개별 염색의 특성에 따라 다릅니다. 세포를 균일하게 염색하는 형광 시약을 사용하여 세포를 염색하는 것이 중요합니다. 실험 조건에 영향을 받는 프로브는 결과의 변동성을 증가시키고 형광 신호와 세포 이동 간의 상관관계를 감소시킵니다. 구체적인 고려 사항은 형광 염색제 제조업체에 문의하세요. 다음은 Calcein AM을 사용하기 위한 형광 염색 프로토콜의 예시입니다:
- 완전히 시드된 플레이트 하나를 염색하려면 5μL의 칼세인 AM(건조 DMSO 1mg/mL)을 페놀 레드 무함유 및 혈청 무함유 배지 10mL 또는 1x PBS(Ca++ 및 Mg++). d단계에서 사용할 준비가 될 때까지 희석된 칼세인 AM 용액을 빛으로부터 보호합니다.
- 웰에서 배양 배지를 조심스럽게 제거합니다.
- 100μL의 PBS로 웰을 세척합니다(Ca++ 및 Mg++). 각 웰에 희석된 칼세인 AM 용액 100μL를 추가합니다. 37°C에서 30~60분간 배양합니다.
- 마스크를 부착하고 적절한 필터 세트와 감도/게인 설정을 사용하여 마이크로 플레이트 리더기로 즉시 판독합니다. BioTek Synergy™ HT 마이크로플레이트 판독기의 경우 485/528nm 여기/발광 필터, 감도 55nm를 사용합니다.
- 아직 설치되어 있지 않은 경우, Oris 감지 마스크를 플레이트에 부착합니다. 형광 마이크로플레이트 판독기의 하단 프로브를 사용하여 각 웰에서 형광 판독값을 얻습니다. 동적 범위를 최적화하려면 기기의 게인을 조정하여 마이그레이션 전 웰과 마이그레이션 후 웰 간의 형광 신호 차이를 최대화합니다. 기기 설정에 대한 자세한 지침은 마이크로플레이트 판독기의 기기 설명서를 참조하세요.
이제 세포 이동 분석을 위한 최적의 세포 시딩 농도와 마이크로플레이트 리더기 설정을 성공적으로 결정했습니다.
추가 팁은 자주 묻는 질문.