Protokoll für den Zellmigrationsassay
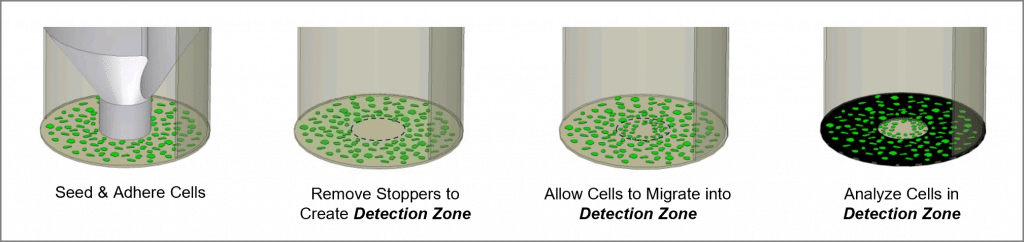
Der Oris Cell Migration Assay ist ein reproduzierbarer, empfindlicher und flexibler Test, der zur Überwachung folgender Punkte verwendet werden kann Zellmigration. Der Test ist für eine 96-Well-Platte formatiert und verwendet Oris Zellaussaatstopper aus medizinischem Silikon, um die Zellaussaat auf die äußeren ringförmigen Bereiche der Wells zu beschränken. Nach dem Entfernen der Stopfen bleibt in der Mitte jeder Vertiefung ein unbesetzter Bereich mit einem Durchmesser von 2 mm frei, die Detektionszone, in die die ausgesäten Zellen dann einwandern können. Die Oris Detection Mask wird auf den Plattenboden aufgebracht und schränkt die Visualisierung auf die Detektionszonen ein, so dass nur Zellen, die gewandert sind, erkannt werden können (siehe Abbildung 1). Der Oris Cell Migration Assay ist so konzipiert, dass er mit jeder handelsüblichen Färbe- oder Markierungstechnik verwendet werden kann. Die Auslesung kann durch Mikroskopie oder mit einem Mikroplatten-Lesegerät erfolgen.
Druckbare Protokolldateien
- Mit Gewebekultur behandelte Oris™-Zellwanderungsplatten (CMA1.101, CMA5.101)
- Mit Kollagen I beschichtete Oris™-Zellwanderungsplatten (CMACC1.101, CMACC5.101)
- Fibronectin-beschichtete Oris™-Zellwanderungsplatten (CMAFN1.101, CMAFN5.101)
Zugehöriges Video: Durchführung eines Zellwanderungstests
Erforderliche Materialien
- Oris Zellmigrations-Assay-Kitumfasst das Folgende:
- Oris 96-Well-Platten mit eingesetzten Oris Cell Seeding Stoppers. Optionen für die Oberflächenbeschichtung:
- Oris Detektionsmaske
- Oris Stopper Werkzeug
- Biologische Zellen
- Sterile phosphatgepufferte Kochsalzlösung (PBS), die sowohl Ca++ und Mg++
- Vollständiges Zellkultur-Wachstumsmedium (serumhaltig)
- Sterile Pipettenspitzen/Pipette oder Mehrkanalpipette
- Trypsin oder Zellschaber
- Umgekehrtes Mikroskop (optional)
- Fluoreszenz-Mikroplattenlesegerät (optional)
- Zellkultur-Markierungsmedium (Phenolrot-/Serum-freies Medium)
- Fluoreszenzmittel zur Zellmarkierung (z. B. CellTracker™ Green, Calcein AM) - erforderlich, wenn der Assay über ein Mikroplatten-Lesegerät ausgelesen wird.
Verfahren für den Zellmigrationsassay
Die folgenden Schritte sollten in einer biologischen Abzugshaube unter Anwendung aseptischer Technik durchgeführt werden, um eine Kontamination zu vermeiden.
- Entfernen Sie den Oris Cell Migration Assay Platte aus der Kühlung nehmen und für 1 Stunde auf den Labortisch stellen, damit es sich an die Raumtemperatur anpasst.
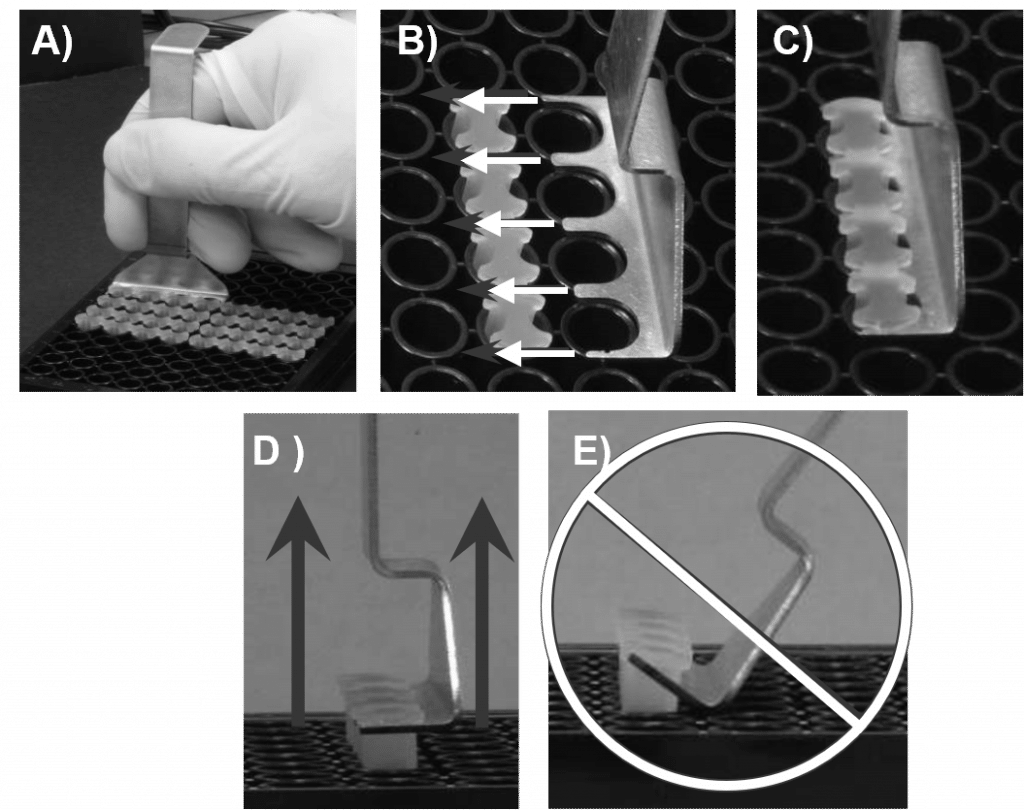
- Überprüfen Sie die Unterseite der 96-Well-Platte visuell, um sicherzustellen, dass die Oris Cell Seeding Stopper fest gegen den Boden der Platte abgedichtet sind. Um die Stopfen zu überprüfen, drehen Sie die Platte um und untersuchen Sie die Stopfen auf Dichtigkeit (siehe Abbildung 2). Wird eine unvollständige Versiegelung festgestellt, die Platte wieder in die aufrechte Position bringen und den Stopfen mit einem sterilen Instrument vorsichtig zurück in die Vertiefung drücken, bis eine Versiegelung festgestellt wird.
- HINWEIS: Die Versiegelung der Stopfen kann leicht beobachtet werden, wenn die Platte schräg gestellt und unter indirektem Licht betrachtet wird, um das "Bullseye"-Muster am Boden jeder Vertiefung zu erkennen.
- Anwenden der Oris Detektion Maske auf den Boden der 96-Well-Platte, wenn Mikroplatten-Reader-Daten erfasst werden. Die Detektionsmaske ist nicht erforderlich, wenn Bildgebungsdaten erfasst werden.
- Richten Sie die abgeschrägten Ecken der Maske an denen der 96-Well-Platte aus und stellen Sie sicher, dass die A1-Ecke der Maske mit der A1-Well der Platte ausgerichtet ist (siehe Abbildung 3).
- Richten Sie die Löcher in den Befestigungslaschen mit den Vorsprüngen am Boden der 96-Well-Platte aus.
- Drücken Sie die Maske vorsichtig an, bis sie mit dem Boden der 96-Well-Platte bündig ist.
- HINWEIS: Es kann erforderlich sein, die Maske mit Ethanol zu waschen, um Staub und Ablagerungen zu entfernen. Die Maske kann zu einem beliebigen Zeitpunkt während des Assays angelegt werden. Bei kinetischen Assays ist es am günstigsten, die Maske aufzusetzen, bevor Flüssigkeiten in die Vertiefungen gegeben werden. Bei Endpunkt-Assays ist es am günstigsten, die Maske unmittelbar vor dem Ablesen der Assay-Ergebnisse aufzusetzen.
- Wenn Sie eine kinetische Analyse der Zellmigration durchführen, markieren Sie jetzt mit einem Fluoreszenzfarbstoff vor.
- Sammeln Sie die Zellen und stellen Sie eine Suspension her, die eine 10-fach höhere Dichte als die optimale Aussaatkonzentration aufweist.
- Erstmalige Benutzer: Die optimale Aussaatdichte der Zellen muss vor der Durchführung des Zellmigrationstests bestimmt werden. Dieser Vorgang wird in Anhang I beschrieben.
- Pipettieren Sie 100 µL der suspendierten Zellen in jede Testvertiefung durch eine der seitlichen Öffnungen des Oris Cell Seeding Stopper.
- HINWEIS: Die besten Ergebnisse erzielen Sie, wenn Sie das Medium mit der Pipettenspitze entlang der Wand der Vertiefung zugeben oder entnehmen (siehe Abbildung 4). Achten Sie darauf, den Oris Cell Seeding Stopper nicht zu verletzen, wenn Sie die Pipettenspitze in das Well einführen. Eine schlanke/verlängerte Spitze oder eine Gel-Ladespitze kann nützlich sein.
- WICHTIG! Klopfen Sie die Platte leicht auf Ihre Arbeitsfläche, um den Inhalt der Vertiefungen gleichmäßig zu verteilen (starkes Klopfen kann zum Verspritzen des Inhalts der Vertiefungen führen und eine Kontamination verursachen).
- Die besetzte Platte 4 bis 18 Stunden lang (je nach Zelllinie) in einer befeuchteten Kammer inkubieren, damit sich die Zellen anlagern können.
- Platte aus dem Inkubator nehmen.
- Bestimmen Sie mehrere "Referenz"-Vertiefungen, in denen die Stopfen bis zum Ablesen der Ergebnisse an Ort und Stelle bleiben (t=0-Kontrollen vor der Migration).
- Entfernen Sie mit dem Oris Stopper Tool alle anderen Stopper (siehe Abbildung 2).
- HINWEIS: Es kann notwendig sein, das Oris Stopper Tool mit 70% Ethanol zu waschen, da das Stopper Tool nicht steril ist.
- Sichern Sie die 96-Well-Platte, indem Sie sie fest gegen das Deck Ihres Arbeitsbereichs drücken. Schieben Sie die Zinken des Oris Stopper Tools unter das Rückgrat des Stopfenstreifens, wobei die Unterseite des Oris Stopper Tools bündig mit der Oberseite der Platte sein muss.
- Das Oris Stopper Tool anheben vertikal um die Stopfen vorsichtig zu entfernen.
- NICHT Verwenden Sie das Oris Stopper Tool als Hebel, um die Stopfen aus der Vertiefung zu hebeln (siehe Abbildung 5E). Dies kann zu einer Verschiebung der ausgesäten Zellen führen und den Bereich der Erkennungszone verzerren.
- Um nicht gebundene Zellen zu entfernen, entfernen Sie das Medium mit einer Pipette und sanft Vertiefungen mit 100 µl sterilem PBS oder Medium waschen. Nicht mit einem hausinternen Vakuum absaugen.
- Geben Sie 100 µl frisches Kulturmedium in jede Vertiefung.
- Inkubieren Sie die Platte in einer befeuchteten Kammer (37°C, 5% CO2), um die Zellmigration zu ermöglichen. Die Zellen können während des gesamten Inkubationszeitraums mikroskopisch untersucht werden, um das Fortschreiten der Migration zu überwachen. Die Migrationszeit variiert je nach Zelltyp und Versuchsaufbau.
- Wenn Sie eine Endpunktanalyse der Zellmigration durchführen, färben Sie die Zellen mit einer Fluoreszenzfärbung, nachdem eine ausreichende Migration stattgefunden hat. Weitere Informationen zur Datenerfassung und zur Technik der Fluoreszenzfärbung finden Sie in Abschnitt VI und Anhang II.
- HINWEIS: Oris Cell Seeding Stopper sind nur für den einmaligen Gebrauch bestimmt; Platypus Technologies kann die Unversehrtheit des Stopfenmaterials nach einem zweiten Sterilisationsvorgang nicht garantieren.
Datenerfassung
Das Auslesen des Oris Cell Migration Assay kann zu jedem beliebigen Zeitpunkt erfolgen, so dass der Benutzer einen kinetischen Assay oder einen Endpunkt-Assay durchführen kann. Der Oris Cell Migration Assay ist so konzipiert, dass er mit jeder handelsüblichen Färbe- oder Markierungstechnik verwendet werden kann. Das Auslesen kann mit einem Mikroskop, einem Mikroplattenlesegerät oder einer High-Content-Imaging-Analyseplattform durchgeführt werden.
Mikroskopische Analyse
Software zur Zellzählung oder Bilderfassung/-analyse, z. B. NIH ImageJ Freeware, kann verwendet werden.
- Hinweis: Mikroskopische Beobachtungen sind mit Phasenkontrast- oder Hellfeldmikroskopie möglich.
- Die Oris Detektionsmaske muss nicht an der Oris Platte befestigt werden.
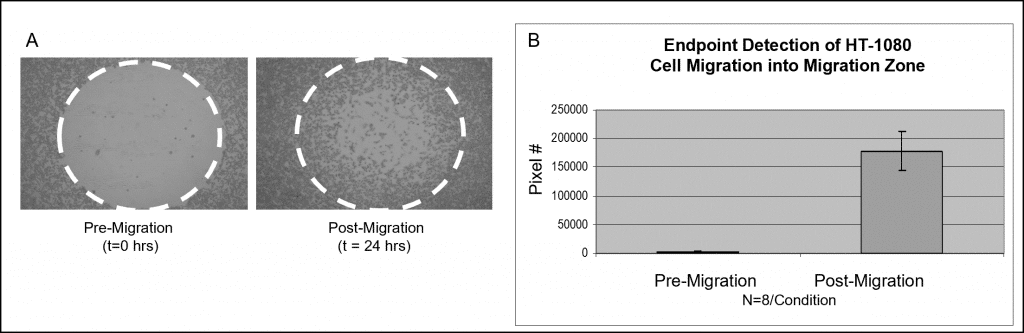
Abbildung 3 zeigt die Probendaten unter Verwendung einer kolorimetrischen Färbung. Mit Oris Cell Seeding Stoppers bestückte Wells wurden mit 50.000 HT-1080-Zellen besiedelt (d. h. 100 µL von 5×105 Zellen/ml) und über Nacht inkubiert. Die Stopfen wurden aus den Testvertiefungen entfernt, blieben aber bis zum Zeitpunkt der Testauswertung in den Prä-Migrations-Referenzvertiefungen eingesetzt. Die besetzte Platte wurde 24 Stunden lang in einer befeuchteten Kammer bebrütet, um die Zellmigration zu ermöglichen. Die Stopfen wurden aus den Referenzvertiefungen entfernt, alle Zellen wurden fixiert und mit Wright-Giemsa-Färbung behandelt. Die Bilder wurden mit der Hellfeldmikroskopie aufgenommen und anschließend in die Software Image J importiert, um sie mit Hilfe von Schwellenwerten zu analysieren. Die nachstehenden Bilder, die ohne eine Erkennungsmaske aufgenommen wurden, zeigen repräsentative Daten aus Vertiefungen vor der Migration (t=0 Std.) und nach der Migration (t=24 Std.) (Abbildung 6A). Das Diagramm zeigt die durchschnittliche Pixelanzahl in den Erkennungszonen für jede Bedingung (Abbildung 6B).
Mikroplatten-Reader-Analyse
- Befestigen Sie die Oris Detektionsmaske an der Unterseite der Oris Platte (siehe Abschnitt V, Schritt 3).
- Die optimalen Einstellungen hängen von der Marke und dem Modell des Mikroplattenlesegeräts ab. Konsultieren Sie Anhang II und das Benutzerhandbuch für Ihr spezielles Gerät.
- Das Mikroplatten-Lesegerät MUSS so eingestellt werden, dass es vom Boden der Platte abliest.
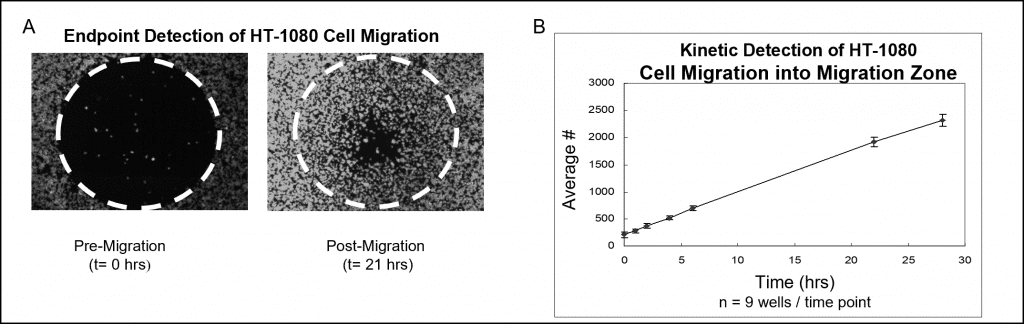
Die Daten der Proben, die mit einer Fluoreszenzfärbung und einem Mikroplattenlesegerät analysiert wurden, sind in Abbildung 7 dargestellt. Die mit Oris Cell Seeding Stoppers bestückten Vertiefungen wurden mit 50.000 HT-1080-Zellen (d. h. 100 μl von 5×105 Zellen/ml) besiedelt und über Nacht inkubiert. Die Stopfen wurden aus den Testvertiefungen entfernt, verblieben aber bis zum Zeitpunkt der Testauswertung in den Referenzvertiefungen vor der Migration. Die Zellen wurden mit CellTracker Green fluoreszierend angefärbt. Die besetzte Platte wurde 28 Stunden lang in einer befeuchteten Kammer bebrütet, und zu verschiedenen Zeitpunkten wurden die Fluoreszenzsignale in den Detektionszonen mit einem Plattenlesegerät gemessen. Die folgenden Bilder (Abbildung 7A), die ohne Detektionsmaske aufgenommen wurden, zeigen repräsentative Daten von Vertiefungen vor der Migration (t=0 Std.) und nach der Migration (t = 21 Std.). Die Grafik zeigt eine Echtzeitanalyse der Zellmigration, die durch Umrechnung des Fluoreszenzsignals in die Zellzahl erstellt wurde (Abbildung 7B).
APPENDIX I: Bestimmung der optimalen Zellkonzentration
Dieses Verfahren soll bei der Bestimmung der Zellaussaatdichte helfen, die erforderlich ist, um eine Konfluenz Ihrer Zelllinie bei Verwendung des Oris™ Cell Migration Assay zu erreichen. Das angestrebte Ziel ist es, eine Konfluenz von 90-95% des Monolayers zu erreichen, der die Oris™ Cell Seeding Stoppers umgibt, ohne dass es zu einem Überwuchern kommt.
- Als Ausgangspunkt wird empfohlen, drei serielle Verdünnungen mit den unten angegebenen Zelldichten zu testen. Die Zellaussaatfläche der Vertiefung beträgt bei eingesetztem Stopfen ~ 0,3 cm2. Ausgehend von der typischen Aussaatdichte Ihrer speziellen Zelllinie können Sie eine andere Zellzahl für Ihre erste Verdünnungsreihe ableiten und die Zahlen unten entsprechend anpassen.
- Bereiten Sie eine Log-Phase-Kultur der zu testenden Zelllinie vor. Sammeln Sie die Zellen und bestimmen Sie die Gesamtzahl der vorhandenen Zellen.
- Zellen durch Zentrifugation pelletieren. Drei Serienverdünnungen mit Endkonzentrationen von 1,0 x 106, 0.5 x 106 und 0,25 x 106 Zellen/ml.
- Geben Sie 100 µL Zellsuspension pro Vertiefung in die 96-Well-Platte, so dass sich folgende Plattenanordnung ergibt:
- Säule #1: 100.000 Zellen pro Vertiefung (8 Vertiefungen)
- Säule #2: 50.000 Zellen pro Vertiefung (8 Vertiefungen)
- Säule #3: 25.000 Zellen pro Vertiefung (8 Vertiefungen)
- Inkubieren Sie die Platte in einer befeuchteten Kammer (37°C, 5% CO2) für 4 - 18 Stunden (abhängig von der Zelllinie) mit eingesetzten Zellaussaat-Stoppern, damit die Zellen fest an der Oberfläche der Vertiefungen anhaften können.
- Nach dem Anbringen der Zellen entfernen Sie die Oris Cell Seeding Stopper aus jeder Vertiefung (siehe Abbildung 5) und sanft Waschen Sie die Vertiefungen mit PBS, um nicht angeheftete Zellen zu entfernen.
- Sichern Sie die 96-Well-Platte, indem Sie sie fest gegen das Deck Ihres Arbeitsbereichs drücken. Schieben Sie die Zinken des Oris Stopper Tools unter das Rückgrat des Stopfenstreifens, wobei die Unterseite des Oris Stopper Tools bündig mit der Oberseite der Platte sein muss.
- Das Oris Stopper Tool anheben vertikal um den Stopfen vorsichtig zu entfernen. Verwenden Sie das Oris Stopper Tool nicht als Hebel, um die Stopfen aus der Vertiefung zu hebeln, da dies zu einer Verschiebung der ausgesäten Zellen führen kann.
- Verwenden Sie ein Mikroskop, um jede Vertiefung ohne Detektionsmaske visuell zu untersuchen und die minimale Zellaussaatkonzentration zu bestimmen, die eine konfluente Monolage am Rand der Detektionszone ergibt.
Zu diesem Zeitpunkt haben Sie die optimale Zellaussaatkonzentration für Schritt 5 des Protokolls zum Zellmigrationsassay erfolgreich bestimmt.
APPENDIX II: Bestimmung der optimalen Einstellungen für das Mikroplatten-Lesegerät
Dieses Verfahren soll Ihnen dabei helfen, die Einstellungen Ihres Geräts zu optimieren, wenn Sie ein Fluoreszenz-Mikroplattenlesegerät zur Erfassung von Daten aus dem Oris Cell Migration Assay verwenden.
- Führen Sie unter Verwendung der optimalen Zellaussaatkonzentration einen Zellmigrationstest unter Kulturbedingungen durch, die voraussichtlich zu einer robusten Zellmigration führen. Achten Sie darauf, eine gleiche Anzahl von Referenzvertiefungen vor der Migration (Stopper bleiben bis zur Färbung an Ort und Stelle) und von Testvertiefungen nach der Migration (Stopper werden nach der Zellanlagerungszeit entfernt) zu verwenden. Es werden mindestens 8 Vertiefungen pro Bedingung empfohlen.
- Führen Sie die gewünschte Fluoreszenzfärbetechnik durch. Der Oris Cell Migration Assay wurde so konzipiert, dass er mit allen Arten von Fluoreszenzfärbungen und Färbetechniken funktioniert. Die genaue Methode zum Färben von Zellen mit Fluoreszenzfarbstoffen hängt von der Art des jeweiligen Farbstoffs ab. Es ist wichtig, die Zellen mit einem fluoreszierenden Reagenz zu färben, das die Zellen gleichmäßig färbt. Sonden, die durch die Versuchsbedingungen beeinflusst werden, erhöhen die Variabilität der Ergebnisse und verringern die Korrelation zwischen Fluoreszenzsignal und Zellmigration. Bitte wenden Sie sich an den Hersteller Ihres Fluoreszenzfarbstoffs, wenn Sie spezielle Fragen haben. Im Folgenden finden Sie ein Beispiel für ein Fluoreszenzfärbeprotokoll zur Verwendung von Calcein AM:
- Zum Anfärben einer vollständig besiedelten Platte werden 5 μl Calcein AM (1 mg/ml in trockenem DMSO) mit 10 mL phenolrot- und serumfreiem Medium oder 1x PBS (das sowohl Ca++ und Mg++). Die verdünnte Calcein AM-Lösung bis zur Verwendung in Schritt d vor Licht schützen.
- Das Kulturmedium vorsichtig aus den Vertiefungen entfernen.
- Vertiefungen mit 100 μl PBS waschen (die sowohl Ca++ und Mg++). 100 μl der verdünnten Calcein AM-Lösung in jede Vertiefung geben. Die Platte 30-60 Minuten lang bei 37 °C inkubieren.
- Bringen Sie die Maske an und lesen Sie sie sofort mit einem Mikroplatten-Lesegerät unter Verwendung des entsprechenden Filtersatzes und der Empfindlichkeits-/Verstärkungseinstellungen ab. Für ein BioTek Synergy™ HT-Mikroplattenlesegerät verwenden Sie 485/528 nm Anregungs-/Emissionsfilter, Empfindlichkeit 55 nm.
- Falls noch nicht vorhanden, bringen Sie die Oris-Detektionsmaske auf der Platte an. Verwenden Sie die untere Sonde eines Fluoreszenz-Mikroplattenlesegeräts, um das Fluoreszenzsignal aus jeder Vertiefung zu erhalten. Um den dynamischen Bereich zu optimieren, stellen Sie die Verstärkung des Geräts so ein, dass der Unterschied im Fluoreszenzsignal zwischen den Wells vor und nach der Migration maximiert wird. Weitere Hinweise zu den Geräteeinstellungen finden Sie in der Bedienungsanleitung Ihres Mikroplatten-Lesegeräts.
Sie haben nun erfolgreich die optimale Zellaussaatkonzentration und die Einstellungen des Mikroplattenlesegeräts für die Analyse der Zellmigration ermittelt.
Weitere Tipps finden Sie in unserem Häufig gestellte Fragen.