Protocolo para el ensayo de migración celular
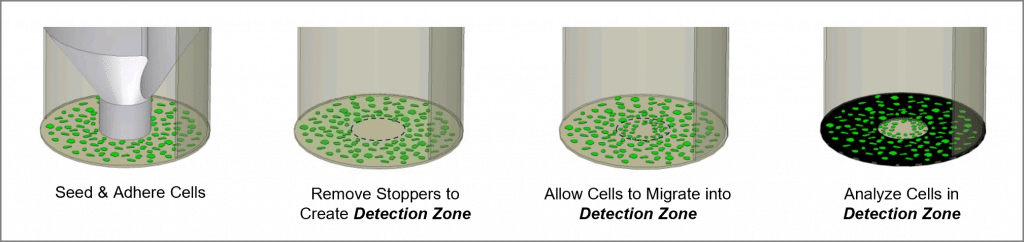
El ensayo de migración celular de Oris es un ensayo reproducible, sensible y flexible que puede utilizarse para monitorizar migración celular. Formateado para una placa de 96 pocillos, el ensayo utiliza tapones de siembra celular Oris fabricados con silicona de grado médico para restringir la siembra celular a las regiones anulares exteriores de los pocillos. La retirada de los tapones deja al descubierto una región no sembrada de 2 mm de diámetro en el centro de cada pocillo, es decir, la zona de detección, a la que pueden migrar las células sembradas. La Oris Detection Mask se aplica al fondo de la placa y restringe la visualización a las zonas de detección, permitiendo que sólo se detecten las células que han migrado (ver Figura 1). El ensayo de migración celular Oris está diseñado para utilizarse con cualquier técnica de tinción o etiquetado disponible en el mercado. La lectura puede realizarse por microscopía o mediante un lector de microplacas.
Archivos de protocolo imprimibles
- Placas de migración celular Oris™ tratadas para cultivo de tejidos (CMA1.101, CMA5.101)
- Placas de migración celular Oris™ recubiertas de colágeno I (CMACC1.101, CMACC5.101)
- Placas de migración celular Oris™ recubiertas de fibronectina (CMAFN1.101, CMAFN5.101)
Vídeo relacionado: Realización de un ensayo de migración celular
Materiales necesarios
- Kit de ensayo de migración celular Orisincluye lo siguiente:
- Placas Oris de 96 pocillos con tapones de siembra celular Oris insertados. Opciones de revestimiento de la superficie:
- Máscara de detección Oris
- Herramienta de tope Oris
- Células biológicas
- Solución salina estéril tamponada con fosfato (PBS) que contiene Ca++ y Mg++
- Medio de cultivo celular completo (con suero)
- Puntas de pipeta estériles/Pipeta o pipeta multicanal
- Tripsina o raspador celular
- Microscopio invertido (opcional)
- Lector de microplacas de fluorescencia (opcional)
- Medio de etiquetado para cultivo celular (medio sin rojo de fenol/suero)
- Agente fluorescente de etiquetado celular (por ejemplo, CellTracker™ Green, Calcein AM) -. si se realiza la lectura del ensayo mediante un lector de microplacas.
Procedimiento para el ensayo de migración celular
Los siguientes pasos deben realizarse en una campana biológica utilizando una técnica aséptica para evitar la contaminación.
- Retirar el ensayo de migración celular Oris Placa de la refrigeración y colóquelo en la mesa de laboratorio durante 1 hora para que se equilibre a temperatura ambiente.
- Inspeccione visualmente la parte inferior de la placa de 96 pocillos para asegurarse de que el Oris Cell Seeding Tapones están firmemente sellados contra el fondo de la placa. Para inspeccionar los tapones, dé la vuelta a la placa y examine el sellado de los tapones. Si se observa un sellado incompleto, vuelva a colocar la placa en posición vertical y utilice un instrumento estéril para volver a introducir suavemente el tapón en el pocillo hasta que se observe el sellado.
- NOTA: el sellado de los tapones puede observarse fácilmente si se inclina la placa y se observa bajo luz indirecta para revelar el patrón de "ojo de buey" en el fondo de cada pocillo.
- Aplicar la detección Oris Máscara al fondo de la placa de 96 pocillos si se están recogiendo datos del lector de microplacas. La máscara de detección no es necesaria si se recogen datos de imágenes.
- Oriente las esquinas biseladas de la máscara con las de la placa de 96 pocillos, asegurándose de que la esquina A1 de la máscara esté alineada con el pocillo A1 de la placa.
- Alinee los orificios de las orejetas de fijación con los resaltes del fondo de la placa de 96 pocillos.
- Presione suavemente la máscara hasta que quede enrasada con el fondo de la placa de 96 pocillos.
- NOTA: Puede ser necesario lavar la máscara con etanol para eliminar el polvo y los residuos. La máscara puede aplicarse en cualquier momento del ensayo. Para ensayos cinéticos, es más conveniente aplicar la máscara antes de colocar cualquier líquido en el pocillo. Para ensayos de punto final, es más conveniente aplicar la máscara justo antes de leer los resultados del ensayo.
- Si va a realizar un análisis cinético de la migración celular, preetiquete ahora con una tinción fluorescente.
- Recoger las células y preparar una suspensión cuya densidad sea 10 veces superior a la concentración óptima de siembra.
- Primeros usuarios: La densidad óptima de siembra de células debe determinarse antes de realizar el ensayo de migración celular. En el Apéndice I se explica este proceso.
- Pipetear 100 µl de células en suspensión en cada pocillo de ensayo a través de uno de los puertos laterales del Oris Cell Seeding Stopper.
- NOTA: Para obtener los mejores resultados, añada o extraiga el medio colocando la punta de la pipeta a lo largo de la pared del pocillo. Al introducir la punta de pipeta en el pocillo, tenga cuidado de no alterar el tapón de siembra celular Oris. Puede ser útil utilizar una punta delgada/alargada o una punta de carga de gel.
- IMPORTANTE: Golpee ligeramente la placa sobre la superficie de trabajo para distribuir uniformemente el contenido de los pocillos (si golpea demasiado, el contenido de los pocillos puede salpicar y contaminarse).
- Incubar la placa sembrada en una cámara humidificada de 4 a 18 horas (dependiendo de la línea celular) para permitir la fijación de las células.
- Retire la placa de la incubadora.
- Designe varios pocillos de "referencia" en los que los tapones permanecerán colocados hasta que se lean los resultados (controles de premigración t=0).
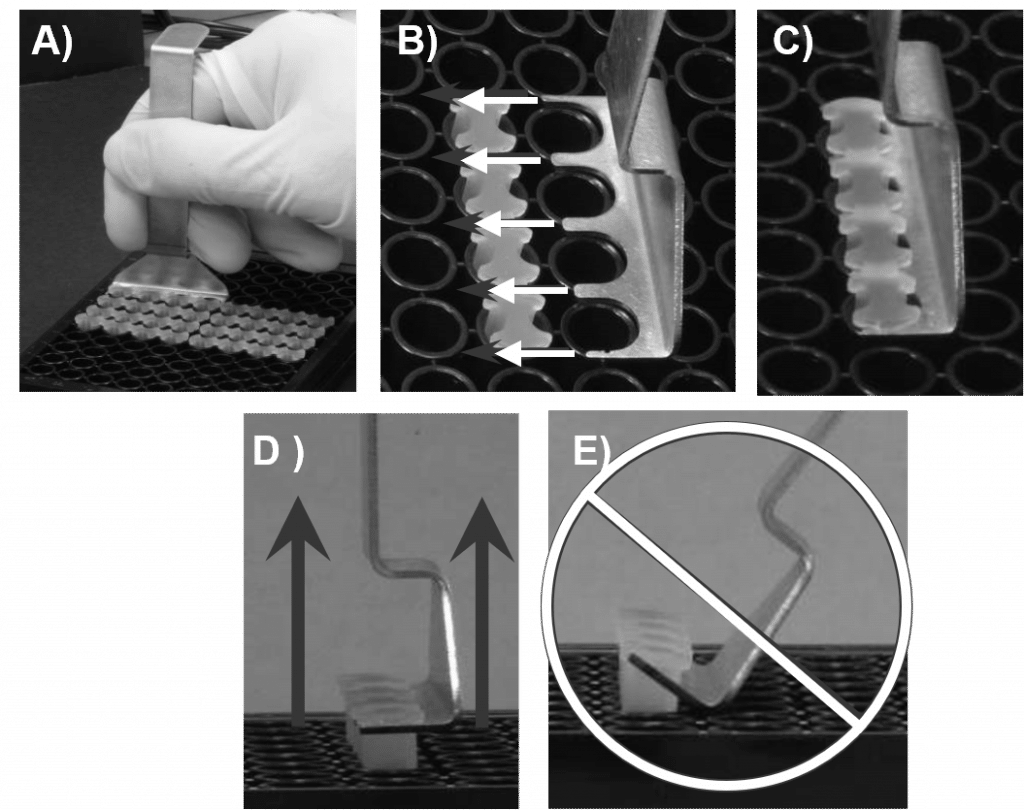
- Con la herramienta Oris Stopper Tool, retire todos los demás topes (véase la figura 2).
- NOTA: Puede ser necesario lavar el Oris Stopper Tool con etanol 70%, ya que el Stopper Tool no es estéril.
- Asegure la placa de 96 pocillos sujetándola firmemente contra la cubierta de su espacio de trabajo. Deslice las púas del Oris Stopper Tool por debajo de la espina dorsal de la tira de tapones, manteniendo la parte inferior del Oris Stopper Tool a ras de la superficie superior de la placa.
- Levante la herramienta Oris Stopper verticalmente para retirar suavemente los tapones.
- NO Utilice el Oris Stopper Tool como palanca para sacar los tapones del pocillo (véase la figura 2E). Esto puede provocar el desplazamiento de las células sembradas y distorsionar el área de la zona de detección.
- Para eliminar las células no adheridas, retire el medio con una pipeta y suavemente lave los pocillos con 100 µl de PBS estéril o medio. No aspire utilizando un aspirador interno.
- Añadir 100 µl de medio de cultivo fresco a cada pocillo.
- Incubar la placa en una cámara humidificada (37°C, 5% CO2) para permitir la migración celular. Las células pueden examinarse al microscopio durante todo el período de incubación para controlar la progresión de la migración. El tiempo de migración variará en función del tipo de célula y del diseño experimental.
- Si se realiza un análisis de punto final de la migración celular, manchar las células con una tinción fluorescente después de que se haya producido una migración suficiente. Consulte la Sección VI y el Apéndice II para obtener más información sobre la adquisición de datos y la técnica de tinción de fluorescencia.
- NOTA: Los tapones Oris Cell Seeding Stoppers son de un solo uso; Platypus Technologies no puede garantizar la integridad del material del tapón tras un segundo procedimiento de esterilización.
Adquisición de datos
La lectura del ensayo de migración celular de Oris puede realizarse en cualquier momento, lo que permite al usuario realizar un ensayo cinético o un ensayo de punto final. El ensayo de migración celular de Oris está diseñado para utilizarse con cualquier técnica de tinción o etiquetado disponible en el mercado. La lectura puede realizarse utilizando un microscopio, un lector de microplacas o una plataforma de análisis de imágenes de alto contenido.
Análisis microscópico
Software de recuento celular o de captura/análisis de imágenes, como NIH ImageJ freeware, puede utilizarse.
- Nota: Las observaciones microscópicas son posibles utilizando el contraste de fases o la microscopía de campo claro.
- No es necesario acoplar la máscara de detección Oris a la placa Oris.
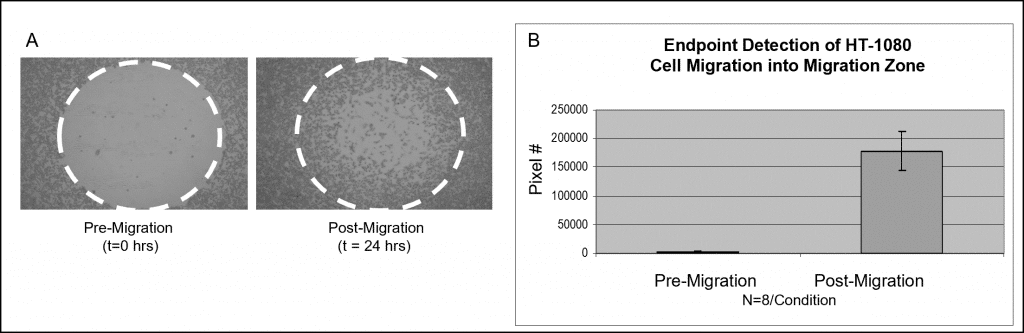
En la Figura 3 se muestran los datos de la muestra utilizando una tinción colorimétrica. Los pocillos rellenados con tapones Oris Cell Seeding Stoppers se sembraron con 50.000 células HT-1080 (es decir, 100 µl de 5×105 células/mL) y se incubaron durante la noche. Se retiraron los tapones de los pocillos de ensayo, pero permanecieron en su lugar en los pocillos de referencia previos a la migración hasta el momento de la lectura del ensayo. La placa sembrada se incubó en una cámara humidificada durante 24 horas para permitir la migración celular. Se retiraron los tapones de los pocillos de referencia y todas las células se fijaron y trataron con tinción de Wright-Giemsa. Las imágenes se capturaron mediante microscopía de campo claro y luego se importaron al software Image J para su análisis mediante umbralización. Las imágenes siguientes, capturadas sin máscara de detección, ilustran datos representativos de pocillos premigración (t=0 horas) y postmigración (t=24 horas) (Figura 3A). El gráfico muestra el número medio de píxeles en las zonas de detección para cada condición (Figura 3B).
Análisis del lector de microplacas
- Coloque la máscara de detección Oris en la parte inferior de la placa Oris (consulte la Sección V, paso 3).
- Los ajustes óptimos variarán según la marca y el modelo del lector de microplacas. Consulte el Apéndice II y el manual del usuario del equipo para su instrumento en particular.
- El lector de microplacas DEBE estar configurado para leer desde el fondo de la placa.
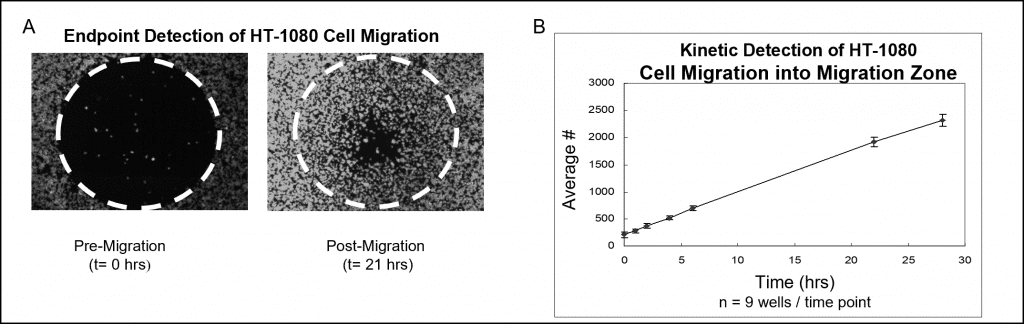
En la Figura 4 se muestran los datos de la muestra utilizando una tinción fluorescente y el análisis del lector de microplacas. Los pocillos poblados con tapones Oris Cell Seeding Stoppers se sembraron con 50.000 células HT-1080 (es decir, 100 μL de 5×105 células/mL) y se incubaron durante la noche. Los tapones se retiraron de los pocillos de ensayo, pero permanecieron en su lugar en los pocillos de referencia previos a la migración hasta el momento de la lectura del ensayo. Las células se tiñeron fluorescentemente con CellTracker Green. La placa sembrada se incubó en una cámara humidificada durante 28 horas y en varios puntos temporales se midieron las señales de fluorescencia en las zonas de detección utilizando un lector de placas. Las imágenes siguientes (Figura 4A), capturadas sin máscara de detección, ilustran datos representativos de pocillos premigración (t = 0 horas) y postmigración (t = 21 horas). El gráfico muestra un análisis en tiempo real de la migración celular que se preparó transponiendo la señal fluorescente en número de células (Figura 4B).
APÉNDICE I: Determinación de la concentración óptima de células
Este procedimiento tiene por objeto ayudar a determinar la densidad de siembra celular necesaria para lograr la confluencia de su línea celular al utilizar el ensayo de migración celular Oris™. El objetivo es lograr una confluencia de 90-95% de la monocapa que rodea los tapones de siembra celular Oris™ sin crecimiento excesivo.
- Un punto de partida sugerido es evaluar tres diluciones seriadas a las densidades celulares que se muestran a continuación. El área de siembra celular del pocillo con el tapón colocado es de ~ 0,3 cm.2. En función de la densidad de siembra típica de su línea celular concreta, puede deducir un número de células diferente para su primera dilución en serie y ajustar los números siguientes en consecuencia.
- Preparar un cultivo en fase logarítmica de la línea celular que se va a analizar. Recoja las células y determine el número total de células presentes.
- Pelear las células por centrifugación. Preparar tres diluciones seriadas a concentraciones finales de 1,0 x 106, 0.5 x 106 y 0,25 x 106 células/mL.
- Dispense 100 µl de suspensión celular por pocillo en la placa de 96 pocillos para obtener la siguiente disposición de la placa:
- Columna #1: 100.000 células por pocillo (8 pocillos)
- Columna #2: 50.000 células por pocillo (8 pocillos)
- Columna #3: 25.000 células por pocillo (8 pocillos)
- Incubar la placa en una cámara humidificada (37°C, 5% CO2) durante 4 - 18 horas (dependiendo de la línea celular) con los tapones de siembra colocados para permitir que las células se adhieran firmemente a la superficie del pocillo.
- Tras la fijación de las células, retire los tapones de siembra celular Oris de cada pocillo (véase la figura 5) y suavemente Lavar los pocillos con PBS para eliminar las células no adheridas.
- Asegure la placa de 96 pocillos sujetándola firmemente contra la cubierta de su espacio de trabajo. Deslice las púas del Oris Stopper Tool por debajo de la espina dorsal de la tira de tapones, manteniendo la parte inferior de la herramienta a ras de la superficie superior de la placa.
- Levante la herramienta Oris Stopper verticalmente para retirar suavemente el tapón. No utilice el Oris Stopper Tool como palanca para sacar los tapones del pocillo, ya que podría provocar el desplazamiento de las células sembradas.
- Sin la máscara de detección colocada, utilice un microscopio para inspeccionar visualmente cada pocillo y determinar la concentración mínima de siembra celular que produce una monocapa confluente en el perímetro de la zona de detección.
En este punto, se ha determinado con éxito la concentración óptima de siembra de células que se utilizará en el paso 5 del protocolo de ensayo de migración celular.
APÉNDICE II: Determinación de los ajustes óptimos para el lector de microplacas
Este procedimiento está pensado para ayudarle a optimizar los ajustes de su instrumento cuando utilice un lector de microplacas de fluorescencia para capturar datos del ensayo de migración celular Oris.
- Utilizando la concentración óptima de siembra celular, realice un ensayo de migración celular utilizando las condiciones de cultivo que se espera que den lugar a una migración celular robusta. Asegúrese de incluir el mismo número de pocillos de referencia previos a la migración (los tapones se dejan colocados hasta la tinción) y pocillos de ensayo posteriores a la migración (los tapones se retiran tras el periodo de fijación celular). Se recomienda un mínimo de 8 pocillos por condición.
- Realice la técnica de tinción fluorescente deseada. El ensayo de migración celular de Oris ha sido diseñado para funcionar con todo tipo de tinciones fluorescentes y técnicas de tinción. El método preciso para teñir las células con tinciones fluorescentes varía según la naturaleza de la tinción individual. Es importante teñir las células con un reactivo fluorescente que las tiña uniformemente. Las sondas afectadas por las condiciones experimentales aumentarán la variabilidad de los resultados y reducirán la correlación entre la señal de fluorescencia y la migración celular. Por favor, consulte al fabricante de su tinte fluorescente para consideraciones específicas. A continuación se muestra un ejemplo de protocolo de tinción fluorescente con calceína AM:
- Para teñir una placa completamente sembrada, combine 5 μL de Calceína AM (1 mg/mL en DMSO seco) con 10 mL de medio libre de rojo de fenol y libre de suero, o 1x PBS (que contiene tanto Ca++ y Mg++). Proteger la solución diluida de Calceína AM de la luz hasta que esté lista para su uso en el paso d.
- Retire con cuidado el medio de cultivo de los pocillos.
- Lavar los pocillos con 100 μL de PBS (que contenga tanto Ca++ y Mg++). Añadir 100 μL de solución diluida de Calceína AM a cada pocillo. Incubar la placa a 37°C durante 30 - 60 minutos.
- Coloque la máscara y lea rápidamente con el lector de microplacas utilizando el conjunto de filtros y los ajustes de sensibilidad/ganancia adecuados. Para un lector de microplacas BioTek Synergy™ HT, utilice filtros de excitación/emisión de 485/528 nm, sensibilidad 55 nm.
- Si aún no está colocada, aplique la máscara de detección Oris a la placa. Con la sonda inferior de un lector de fluorescencia de microplacas, obtenga la lectura de fluorescencia de cada pocillo. Para optimizar el rango dinámico, ajuste la ganancia del instrumento para maximizar la diferencia en la señal de fluorescencia entre los pocillos anteriores y posteriores a la migración. Consulte el manual del instrumento de su lector de microplacas para obtener más información sobre los ajustes del instrumento.
Ahora ha determinado con éxito la concentración óptima de siembra celular y los ajustes del lector de microplacas para el análisis de la migración celular.
Más consejos en nuestro Preguntas frecuentes.