Protocole pour l'essai de migration cellulaire
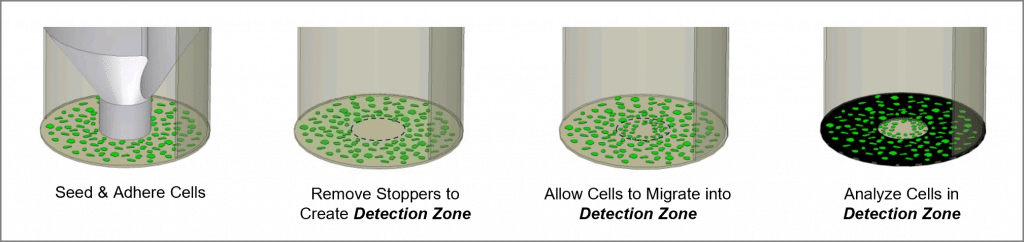
Le test de migration cellulaire Oris est un test reproductible, sensible et flexible qui peut être utilisé pour contrôler migration cellulaire. Conçu pour une plaque à 96 puits, le test utilise des bouchons d'ensemencement cellulaire Oris en silicone de qualité médicale pour limiter l'ensemencement des cellules aux régions annulaires extérieures des puits. Le retrait des bouchons révèle une région non ensemencée de 2 mm de diamètre au centre de chaque puits, c'est-à-dire la zone de détection, dans laquelle les cellules ensemencées peuvent ensuite migrer. Le masque de détection Oris est appliqué sur le fond de la plaque et limite la visualisation aux zones de détection, permettant de détecter uniquement les cellules qui ont migré (voir figure 1). Le test de migration cellulaire Oris est conçu pour être utilisé avec n'importe quelle technique de coloration ou de marquage disponible dans le commerce. La lecture peut être effectuée par microscopie ou à l'aide d'un lecteur de microplaques.
Fichiers de protocole imprimables
- Plaques de migration cellulaire Oris™ traitées en culture de tissus (CMA1.101, CMA5.101)
- Plaques de migration cellulaire Oris™ recouvertes de collagène I (CMACC1.101, CMACC5.101)
- Plaques de migration cellulaire Oris™ recouvertes de fibronectine (CMAFN1.101, CMAFN5.101)
Vidéo connexe : Réalisation d'un essai de migration cellulaire
Matériel nécessaire
- Kit d'essai de migration cellulaire OrisL'ensemble du programme comprend les éléments suivants :
- Plaques 96 puits Oris avec bouchons d'ensemencement cellulaire Oris insérés. Options pour le revêtement de surface :
- Masque de détection Oris
- Oris Stopper Tool
- Cellules biologiques
- Une solution saline stérile tamponnée au phosphate (PBS) contenant à la fois du Ca++ et Mg++
- Milieu de croissance complet pour culture cellulaire (contenant du sérum)
- Pointes de pipette stériles/pipette ou pipette multicanaux
- Trypsine ou grattoir à cellules
- Microscope inversé (facultatif)
- Lecteur de microplaques à fluorescence (en option)
- Milieu de marquage pour culture cellulaire (milieu sans rouge de phénol/sérum)
- Agent fluorescent pour le marquage des cellules (p. ex. CellTracker™ Green, Calcein AM) - nécessaire si la lecture de l'essai se fait via un lecteur de microplaques.
Procédure pour l'essai de migration cellulaire
Les étapes suivantes doivent être effectuées dans une hotte biologique en utilisant une technique aseptique pour éviter toute contamination.
- Retirer l'essai de migration cellulaire Oris Assiette Retirer le produit de la réfrigération et le placer sur la paillasse du laboratoire pendant une heure pour lui permettre de s'équilibrer à la température ambiante.
- Inspecter visuellement le dessous de la plaque à 96 puits pour s'assurer que l'Oris Cell Seeding Bouchons sont fermement scellés contre le fond de la plaque. Pour inspecter les bouchons, retourner la plaque et examiner les bouchons pour voir s'ils sont scellés (voir figure 2). Si une étanchéité incomplète est observée, remettre la plaque en position verticale et utiliser un instrument stérile pour repousser doucement le bouchon dans le puits jusqu'à ce que l'étanchéité soit observée.
- NOTE : le scellement des bouchons peut être facilement observé si la plaque est inclinée et observée sous une lumière indirecte pour révéler le motif "œil de bœuf" au fond de chaque puits.
- Appliquer la détection Oris Masque au fond de la plaque à 96 puits si les données du lecteur de microplaques sont collectées. Le masque de détection n'est pas nécessaire si des données d'imagerie sont collectées.
- Orienter les coins chanfreinés du masque avec ceux de la plaque à 96 puits, en veillant à ce que le coin A1 du masque soit aligné avec le puits A1 de la plaque (voir figure 3).
- Aligner les trous des pattes de fixation sur les bossages situés au fond de la plaque à 96 puits.
- Appuyer doucement sur le masque jusqu'à ce qu'il affleure le fond de la plaque à 96 puits.
- NOTE : Il peut être nécessaire de laver le masque avec de l'éthanol pour éliminer la poussière et les débris. Le masque peut être appliqué à n'importe quel moment de l'essai. Pour les essais cinétiques, il est plus pratique d'appliquer le masque avant de placer des liquides dans le puits. Pour les essais finaux, il est plus pratique d'appliquer le masque juste avant de lire les résultats de l'essai.
- Si vous effectuez une analyse cinétique de la migration cellulaire, pré-étiqueter avec un colorant fluorescent.
- Recueillir les cellules et préparer une suspension dont la densité est 10 fois supérieure à la concentration optimale d'ensemencement.
- Premiers utilisateurs: La densité optimale d'ensemencement des cellules doit être déterminée avant d'effectuer l'essai de migration cellulaire. Veuillez vous référer à l'annexe I pour une discussion sur ce processus.
- Introduire à la pipette 100 µl de cellules en suspension dans chaque puits de test par l'un des orifices latéraux de l'Oris Cell Seeding Stopper.
- NOTE : Pour de meilleurs résultats, ajouter ou extraire le milieu en plaçant l'embout de la pipette le long de la paroi du puits (voir Figure 4). Veiller à ne pas déranger le bouchon Oris Cell Seeding Stopper lors de l'introduction de l'embout de la pipette dans le puits. Une pointe fine/allongée ou une pointe de chargement de gel peut être utile.
- IMPORTANT : Tapotez légèrement la plaque sur votre surface de travail pour répartir uniformément le contenu des puits (un tapotement extrême peut entraîner des éclaboussures du contenu des puits et provoquer une contamination).
- Incuber la plaque ensemencée dans une chambre humidifiée pendant 4 à 18 heures (en fonction de la lignée cellulaire) pour permettre l'attachement des cellules.
- Retirer la plaque de l'incubateur.
- Désigner plusieurs puits de "référence" dans lesquels les bouchons resteront en place jusqu'à la lecture des résultats (contrôles de pré-migration t=0).
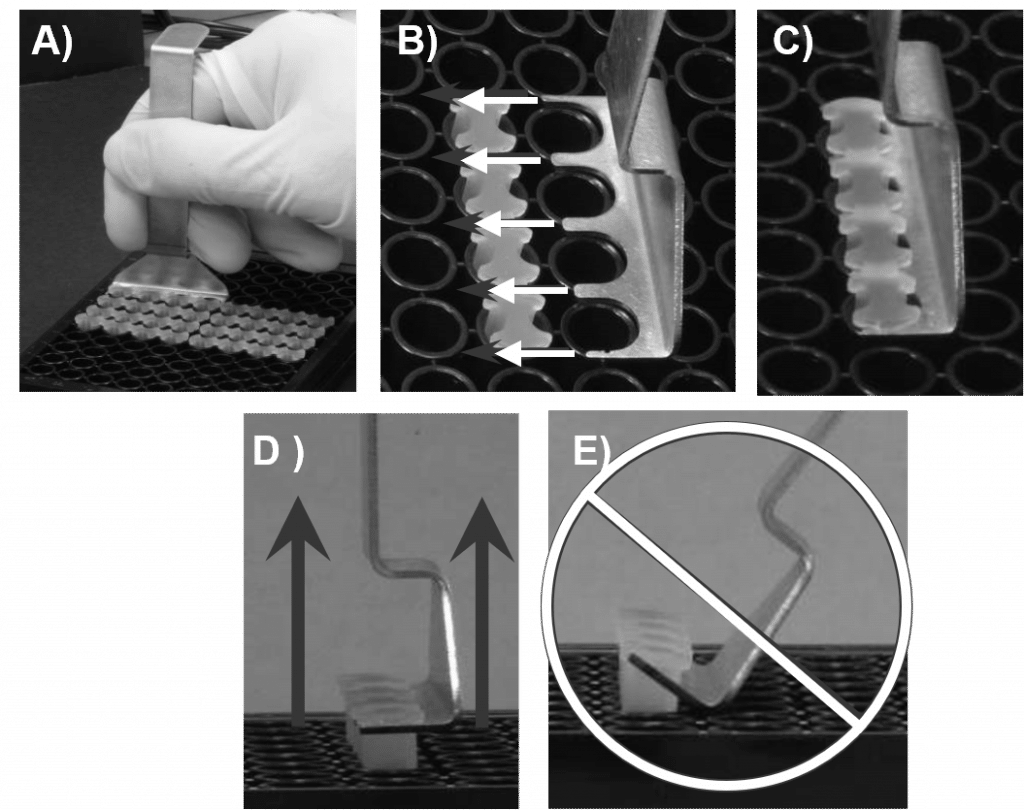
- A l'aide de l'outil Oris Stopper Tool, retirer tous les autres bouchons (voir figure 2).
- NOTE : Il peut être nécessaire de laver la pince Oris avec de l'éthanol 70%, car la pince n'est pas stérile.
- Fixer la plaque de 96 puits en la tenant fermement contre le plateau de votre espace de travail. Glisser les dents de l'outil d'obturation Oris sous l'épine dorsale de la bande d'obturation, en maintenant le dessous de l'outil d'obturation Oris au même niveau que la surface supérieure de la plaque.
- Soulever l'outil Oris Stopper verticalement pour retirer délicatement les bouchons.
- NE PAS utiliser l'outil Oris Stopper Tool comme levier pour retirer les bouchons du puits (voir figure 5E). Cela peut entraîner un déplacement des cellules ensemencées et une distorsion de la zone de détection.
- Pour éliminer les cellules non attachées, retirer le milieu à l'aide d'une pipette, puis le retirer à l'aide d'une pipette. en douceur laver les puits avec 100 µl de PBS stérile ou de milieu. Ne pas aspirer à l'aide d'un aspirateur interne.
- Ajouter 100 µl de milieu de culture frais dans chaque puits.
- Incuber la plaque dans une chambre humidifiée (37°C, 5% CO2) pour permettre la migration des cellules. Les cellules peuvent être examinées au microscope tout au long de la période d'incubation pour suivre la progression de la migration. Le temps de migration varie en fonction du type de cellule et du protocole expérimental.
- Si vous effectuez une analyse finale de la migration cellulaire, colorez les cellules avec un colorant fluorescent une fois que la migration est suffisante. Se reporter à la section VI et à l'annexe II pour de plus amples informations sur l'acquisition des données et la technique de coloration fluorescente.
- NOTE : Les bouchons d'ensemencement cellulaire Oris sont à usage unique ; Platypus Technologies ne peut pas garantir l'intégrité du matériau du bouchon après une deuxième procédure de stérilisation.
Acquisition de données
La lecture du test de migration cellulaire d'Oris peut être effectuée à tout moment, ce qui permet à l'utilisateur d'effectuer un test cinétique ou un test de point final. Le test de migration cellulaire d'Oris est conçu pour être utilisé avec n'importe quelle technique de coloration ou de marquage disponible dans le commerce. La lecture peut être effectuée à l'aide d'un microscope, d'un lecteur de microplaques ou d'une plateforme d'analyse d'imagerie à haut contenu.
Analyse au microscope
Logiciel de comptage de cellules ou de capture/analyse d'images, tel que NIH ImageJ peut être utilisé.
- Note : Les observations microscopiques sont possibles en utilisant la microscopie à contraste de phase ou à champ clair.
- Il n'est pas nécessaire de fixer le masque de détection Oris à la plaque Oris.
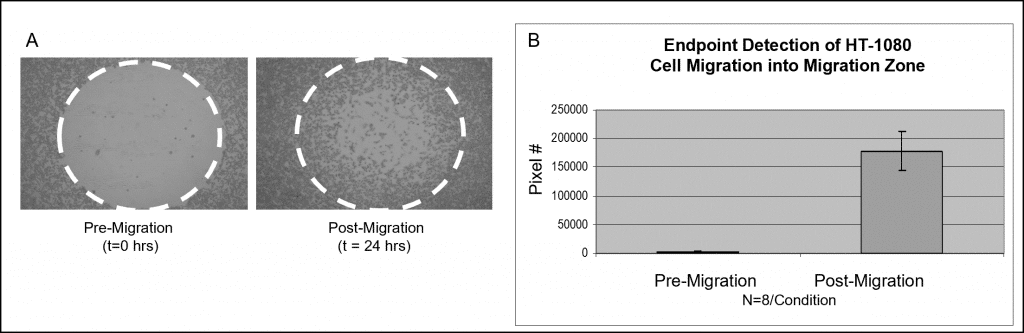
La figure 3 présente un exemple de données utilisant une coloration colorimétrique. Des puits garnis de Cell Seeding Stoppers d'Oris ont été ensemencés avec 50 000 cellules HT-1080 (c'est-à-dire 100 µl de 5×105 cellules/mL) et incubés pendant la nuit. Les bouchons ont été retirés des puits de test mais sont restés en place dans les puits de référence pré-migration jusqu'au moment de la lecture de l'essai. La plaque ensemencée a été incubée dans une chambre humidifiée pendant 24 heures pour permettre la migration des cellules. Les bouchons ont été retirés des puits de référence et toutes les cellules ont été fixées et traitées avec le colorant Wright-Giemsa. Les images ont été capturées à l'aide d'un microscope à champ clair, puis importées dans le logiciel Image J pour être analysées à l'aide d'un seuillage. Les images ci-dessous, capturées sans masque de détection, illustrent des données représentatives des puits pré-migration (t=0 h) et post-migration (t=24 h) (figure 6A). Le graphique représente le nombre moyen de pixels dans les zones de détection pour chaque condition (figure 6B).
Analyse du lecteur de microplaques
- Fixer le masque de détection Oris au bas de la plaque Oris (voir section V, étape 3).
- Les réglages optimaux varient en fonction de la marque et du modèle du lecteur de microplaques. Consulter l'annexe II et le manuel d'utilisation de l'appareil.
- Le lecteur de microplaques DOIT être réglé pour lire à partir du fond de la plaque.
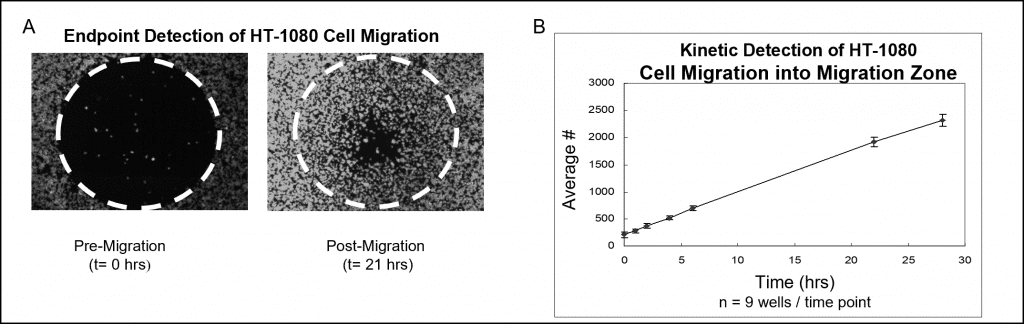
Les données d'échantillons utilisant une coloration fluorescente et une analyse par lecteur de microplaques sont présentées dans la figure 7. Les puits garnis de bouchons d'ensemencement cellulaire Oris ont été ensemencés avec 50 000 cellules HT-1080 (c'est-à-dire 100 μL de 5×105 cellules/mL) et incubés pendant la nuit. Les bouchons ont été retirés des puits de test mais sont restés en place dans les puits de référence pré-migration jusqu'au moment de la lecture de l'essai. Les cellules ont été colorées par fluorescence avec CellTracker Green. La plaque ensemencée a été incubée dans une chambre humidifiée pendant 28 heures et, à différents moments, les signaux de fluorescence dans les zones de détection ont été mesurés à l'aide d'un lecteur de plaque. Les images ci-dessous (figure 7A), capturées sans masque de détection, illustrent des données représentatives de puits pré-migration (t=0 h) et post-migration (t = 21 h). Le graphique illustre une analyse en temps réel de la migration cellulaire qui a été préparée en transposant le signal fluorescent en nombre de cellules (figure 7B).
ANNEXE I : Détermination de la concentration optimale de cellules
Cette procédure a pour but d'aider à déterminer la densité d'ensemencement cellulaire nécessaire pour atteindre la confluence de votre lignée cellulaire lors de l'utilisation du test de migration cellulaire Oris™. L'objectif est d'obtenir une confluence de 90-95% de la monocouche entourant les bouchons d'ensemencement cellulaire Oris™ sans surcroissance.
- Un point de départ suggéré est d'évaluer trois dilutions en série aux densités cellulaires indiquées ci-dessous. La zone d'ensemencement des cellules du puits avec le bouchon en place est d'environ 0,3 cm.2. En fonction de la densité d'ensemencement typique de votre lignée cellulaire, vous pouvez déduire un nombre de cellules différent pour votre première dilution en série et ajuster les chiffres ci-dessous en conséquence.
- Préparer une culture en phase logarithmique de la lignée cellulaire à tester. Prélever des cellules et déterminer le nombre total de cellules présentes.
- Concentrer les cellules par centrifugation. Préparer trois dilutions en série à des concentrations finales de 1,0 x 106, 0.5 x 106 et 0,25 x 106 cellules/mL.
- Distribuer 100 µl de suspension cellulaire par puits dans la plaque à 96 puits afin d'obtenir la disposition de plaque suivante :
- Colonne #1 : 100 000 cellules par puits (8 puits)
- Colonne #2 : 50 000 cellules par puits (8 puits)
- Colonne #3 : 25 000 cellules par puits (8 puits)
- Incuber la plaque dans une chambre humidifiée (37°C, 5% CO2) pendant 4 à 18 heures (en fonction de la lignée cellulaire) avec les bouchons d'ensemencement en place pour permettre aux cellules de se fixer fermement à la surface du puits.
- Une fois les cellules fixées, retirer les bouchons d'ensemencement cellulaire Oris de chaque puits (voir figure 5) et les retirer. en douceur laver les puits avec du PBS pour éliminer les cellules non attachées.
- Fixer la plaque de 96 puits en la tenant fermement contre le plateau de votre espace de travail. Glisser les dents de l'outil d'obturation Oris sous l'épine dorsale de la bande d'obturation, en maintenant le dessous de l'outil d'obturation Oris au même niveau que la surface supérieure de la plaque.
- Soulever l'outil Oris Stopper verticalement pour retirer délicatement le bouchon. Ne pas utiliser l'outil Oris Stopper Tool comme levier pour extraire les bouchons du puits, car cela pourrait entraîner le déplacement des cellules ensemencées.
- Sans masque de détection, utiliser un microscope pour inspecter visuellement chaque puits afin de déterminer la concentration minimale d'ensemencement de cellules qui permet d'obtenir une monocouche confluente au périmètre de la zone de détection.
À ce stade, vous avez déterminé avec succès la concentration optimale d'ensemencement des cellules à utiliser à l'étape 5 du protocole d'essai de migration cellulaire.
ANNEXE II : Détermination des réglages optimaux pour le lecteur de microplaques
Cette procédure a pour but de vous aider à optimiser les réglages de votre instrument lors de l'utilisation d'un lecteur de microplaques à fluorescence pour capturer les données du test de migration cellulaire Oris.
- En utilisant la concentration optimale d'ensemencement des cellules, effectuer un essai de migration cellulaire en utilisant des conditions de culture qui devraient entraîner une migration cellulaire robuste. Veiller à inclure un nombre égal de puits de référence pré-migration (bouchons laissés en place jusqu'à la coloration) et de puits de test post-migration (bouchons retirés après la période d'attachement des cellules). Un minimum de 8 puits par condition est recommandé.
- Effectuer la technique de coloration fluorescente souhaitée. Le test de migration cellulaire Oris a été conçu pour fonctionner avec tous les types de colorants fluorescents et de techniques de coloration. La méthode précise de coloration des cellules avec des colorants fluorescents varie en fonction de la nature du colorant individuel. Il est important de colorer les cellules à l'aide d'un réactif fluorescent qui colore uniformément les cellules. Les sondes affectées par les conditions expérimentales augmenteront la variabilité des résultats et réduiront la corrélation entre le signal de fluorescence et la migration des cellules. Veuillez consulter le fabricant de votre colorant fluorescent pour des considérations spécifiques. Voici un exemple de protocole de coloration fluorescente pour l'utilisation de la calcéine AM :
- Pour colorer une plaque entièrement ensemencée, combiner 5 μL de Calcein AM (1 mg/mL dans du DMSO sec) avec 10 mL de milieu sans rouge de phénol et sans sérum, ou 1x PBS (contenant à la fois du Ca++ et Mg++). Protéger la solution diluée de calcéine AM de la lumière jusqu'à ce qu'elle soit prête à être utilisée à l'étape d.
- Retirer avec précaution le milieu de culture des puits.
- Laver les puits avec 100 μL de PBS (contenant à la fois du Ca++ et Mg++). Ajouter 100 μL de solution diluée de Calcéine AM dans chaque puits. Incuber la plaque à 37°C pendant 30 à 60 minutes.
- Fixer le masque et lire rapidement avec un lecteur de microplaques en utilisant le jeu de filtres et les réglages de sensibilité/gain appropriés. Pour un lecteur de microplaques BioTek Synergy™ HT, utiliser des filtres d'excitation/émission 485/528 nm, sensibilité 55 nm.
- S'il n'est pas déjà en place, appliquer le masque de détection Oris sur la plaque. A l'aide de la sonde inférieure d'un lecteur de microplaques à fluorescence, obtenir la lecture de la fluorescence de chaque puits. Pour optimiser la gamme dynamique, ajuster le gain de l'instrument afin de maximiser la différence de signal de fluorescence entre les puits pré-migration et post-migration. Se référer au manuel de l'instrument de votre lecteur de microplaques pour plus d'informations sur les réglages de l'instrument.
Vous avez maintenant déterminé avec succès la concentration optimale d'ensemencement des cellules et les paramètres du lecteur de microplaques pour l'analyse de la migration cellulaire.
Vous trouverez d'autres conseils dans notre Questions fréquemment posées.