Vergleich des Oris-Zellwanderungstests mit dem Scratch-Assay
Die Zellmigration ist ein wesentlicher Bestandteil vieler physiologischer Prozesse, einschließlich der Embryonalentwicklung, der Geweberegeneration und der Wundheilung. Darüber hinaus, Zellmigration ist an der Metastasierung von Tumoren und Atherosklerose beteiligt. Ein Test, der häufig zur Untersuchung der Zellmigration verwendet wird in vitro ist der Scratch-Assay. Der Scratch-Test wird durchgeführt, indem eine zellfreie Lücke oder ein "Kratzer" auf einer konfluenten Zellschicht erzeugt wird, woraufhin sich die Zellen am Rand der Öffnung nach innen bewegen, um den Kratzer zu schließen. Die Zellmigration kann durch den Vergleich von Bildern bewertet werden, die zu Beginn der Entstehung des Kratzers und in benutzerdefinierten Abständen während des Schließens des Kratzers aufgenommen wurden. Der Scratch-Assay ist einfach durchzuführen und kostengünstig. Die Methoden zur Erzeugung des Kratzers variieren jedoch von Labor zu Labor und die Ergebnisse können sehr unterschiedlich sein. Außerdem hat sich gezeigt, dass der Prozess der Kratzerbildung die zugrunde liegende extrazelluläre Matrix beschädigen (ECM).
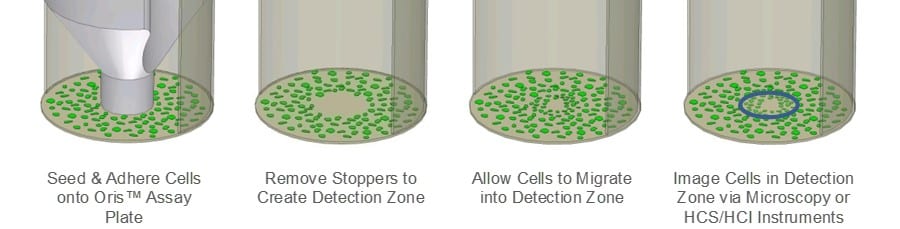
Der Oris Cell Migration Assay (CMA) wurde entwickelt, um die Grenzen des Scratch Assay zu überwinden. Der Oris CMA (Abbildung 1) verwendet eine Platte mit 96 Vertiefungen, die mit Silikonstopfen versehen sind, die die Zellen aus der zentralen Detektionszone der Vertiefung ausschließen. Nach dem Aussäen und Anhaften der Zellen werden die Silikonstopfen entfernt, so dass in der Mitte jeder Vertiefung ein unbesetzter Bereich sichtbar wird, in den die Zellen einwandern können. Die Reproduzierbarkeit des Assays ist beim Oris CMA im Vergleich zum Scratch-Assay höher, da die Detection Zones gleichmäßig groß sind und die darunter liegende ECM durch den Silikonstopfen nicht beschädigt wird.
Dieser Anwendungshinweis bietet einen direkten Vergleich zwischen dem Oris CMA und dem Scratch-Assay zur Bewertung der Zellmigration. Außerdem wird die Integrität der ECM in beiden Testformaten bewertet.
Materialien und Methoden
Alle Schritte für den Oris CMA und den Scratch-Assay wurden parallel am selben Tag durchgeführt.
Oris-Zellwanderungs-Assay: Jede Vertiefung einer Oris TC-Platte mit 96 Vertiefungen wurde mit 9 µg/ml Kollagen I (Trevigen) beschichtet und über Nacht bei 37 °C inkubiert.oC/5%CO2. Nach der Inkubation wurden die Vertiefungen gespült und die Oris Cell Seeding Stopper entfernt und eingesetzt. MDA-MB-231 humane Brustepithelzellen (25.000 Zellen/100µl) wurden in alle Testvertiefungen der Oris Assay-Platte ausgesät. Sobald sich eine konfluente Monoschicht gebildet hatte, wurden die Zellen 24 Stunden lang serumarm gemacht, die Stopfen entfernt und das Medium durch serumhaltiges Medium ersetzt. Unmittelbar nach dem Entfernen der Stopfen wurden mit einem Zeiss Axiovert Mikroskop mit angeschlossener CCD-Kamera Phasenbilder aufgenommen, um den Bereich vor der Migration der zellfreien Detektionszone zu dokumentieren. Die Oris-Assay-Platte wurde dann bei 37oC/5% CO2 um die Zellwanderung zu ermöglichen.
Scratch Assay: Jede Vertiefung einer Costar® 6-Well-Platte wurde mit 9 µg/ml Kollagen I (Trevigen) beschichtet und über Nacht bei 37 °C inkubiert.oC/5% CO2. Nach der Inkubation wurden die Vertiefungen gespült und MDA-MB-231-Zellen (500.000 Zellen/2 ml) in jede Vertiefung der Costar®-Platte gesät. Sobald sich eine konfluente Monoschicht gebildet hatte, wurden die Zellen 24 Stunden lang serumfrei gehalten. Anschließend wurden die Zellmonoschichten mit einer 1000-µl-Pipettenspitze angekratzt und serumhaltiges Medium in jede Vertiefung gegeben. Mit einem Filzstift wurde ein Referenzpunkt in der Nähe des Kratzers in jeder Vertiefung markiert, und von jedem Kratzer wurden Phasenbilder aufgenommen, um den Prä-Migrationsbereich der zellfreien Detektionszone zu dokumentieren. Parallel zur Oris-Assay-Platte wurde die Scratch-Assay-Platte bei 37 °C gelagert.oC/5% CO2 um die Zellwanderung zu ermöglichen.
Nach 24 Stunden wurden die Testvertiefungen sowohl der Oris-Testplatte als auch der Scratch-Testplatte mit 0,25% Glutaraldehyd fixiert. In beiden Assays wurden Phasenbilder aufgenommen, um die Migrationszeitpunkte zu dokumentieren. Als Referenzpunkt wurde derselbe Bereich des Kratzers wie auf dem Bild vor der Migration verwendet. In beiden Assayformaten wurde die Zellmigration durch Messung der Fläche der Detektionszone zu den Prä-Migrations- und den entsprechenden Migrationszeitpunkten unter Verwendung von ImageJ v1.42l Analysesoftware. Die Zellmigration wird als prozentualer Verschluss dargestellt, der anhand der folgenden Gleichung berechnet wird:
((Vor der Migration)Bereich - (Migration)Bereich ) x 100 / (vor der Abwanderung)Bereich
ECM-Integritätstest: Um die Integrität der ECM in jedem Assay zu testen, wurden 100 µg/ml Kollagen Typ I - FITC-Konjugat (Sigma-Aldrich) auf die Vertiefungen einer Oris Assay-Platte (ohne Stopfen) und einer Costar®-Platte aufgetragen und über Nacht bei 37 °C inkubiert.oC/5% CO2. Nach der Inkubation wurden Stopfen in die Oris-Assay-Platte eingesetzt und steriles PBS in die Vertiefungen der beiden Assay-Platten gegeben. 1 Stunde, 24 Stunden und 48 Stunden nach dem Einsetzen wurden die Stopfen entfernt und Fluoreszenzbilder mit einem inversen Zeiss Axiovert Mikroskop aufgenommen. Zu jedem der oben genannten Zeitpunkte wurden Kratzer in die Costar®-Platte gemacht und Bilder mit denselben Einstellungen wie bei der Oris-Assay-Platte aufgenommen.
Ergebnisse
Die Migration von MDA-MB-231-Zellen auf mit Kollagen I beschichteten Oberflächen wurde mit zwei verschiedenen Migrationstests verglichen: dem Oris CMA und dem Scratch-Assay. Vier separate Experimente wurden parallel an verschiedenen Tagen durchgeführt, um die Leistung der einzelnen Assays zu vergleichen. Bei jedem unabhängigen Experiment lag die mit dem Oris CMA erzielte durchschnittliche Flächenschließung (Abbildung 2A und B) zwischen 87% und 89% mit einem Varianzkoeffizienten von 3,7-6,5% (Abbildung 2E). Im Gegensatz dazu lag der durchschnittliche Flächenschluss, der mit dem Scratch Assay (Abbildung 2C und D) ermittelt wurde, zwischen 69%-77% mit einem Varianzkoeffizienten von 11,3-25,6% (Abbildung 2E). Diese Ergebnisse zeigen, dass der Oris CMA konsistentere Ergebnisse zwischen den Experimenten mit einer größeren Reproduzierbarkeit im Vergleich zu den mit dem Scratch Assay erzielten Ergebnissen liefert.
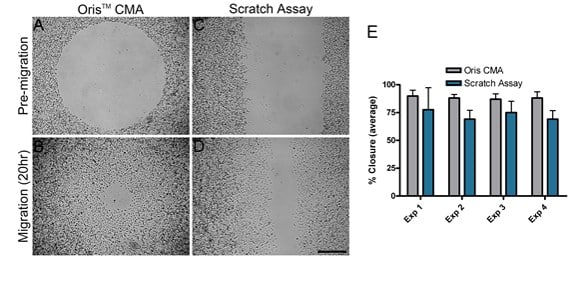
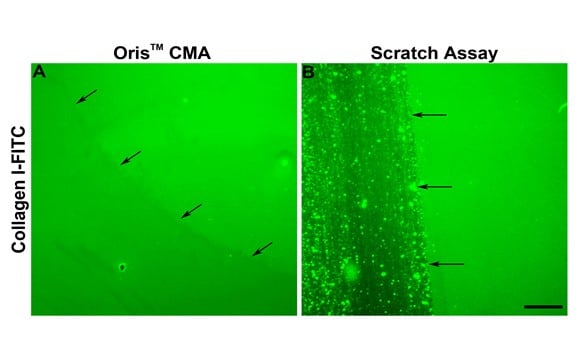
Wie in Abbildung 2E dargestellt, war die Zellmigration im Scratch-Assay durchweg geringer als im Oris-Assay beobachtet. Ein Grund für die geringere Zellmigration im Scratch-Assay könnte die Schädigung der ECM während der Kratzerbildung sein. Kam et al. (2008) haben gezeigt, dass die ECM während der Kratzbildung beschädigt werden kann. Um festzustellen, ob dies in dieser Studie zutrifft, wurde die Unversehrtheit der Kollagenbeschichtung nach dem Entfernen des Stopfens und der Kratzerbildung untersucht. Der Oris Cell Seeding Stopper beeinträchtigte die Kollagenbeschichtung nicht, wie die gleichmäßige Fluoreszenz im gesamten Bildfeld zeigt (Abbildung 3A). Bei der Verwendung von Testplatten, die mit FITC-markiertem Kollagen I beschichtet waren, wurde die Kollagenbeschichtung hingegen durch die Kratzerbildung beschädigt, was mit veröffentlichten Ergebnissen übereinstimmt (Abbildung 3B). Diese Ergebnisse deuten darauf hin, dass eine Schädigung der darunter liegenden Kollagenbeschichtung zu der mit dem Scratch-Assay beobachteten verminderten Zellmigration beitragen kann.
Schlussfolgerungen
Diese Application Note vergleicht die Leistung des Oris Cell Migration Assay mit dem üblicherweise verwendeten Scratch Assay. Die Ergebnisse dieser Studie zeigen, dass der Oris CMA im Vergleich zum Scratch Assay konsistentere Ergebnisse zwischen den Experimenten und eine bessere Reproduzierbarkeit ermöglicht. Im Gegensatz zur mechanischen Kratzerbildung beim Scratch Assay wird durch die Verwendung eines Silikonstopfens beim Oris CMA die darunter liegende ECM nicht beschädigt. Insgesamt verdeutlichen diese Ergebnisse die Vorteile des Oris CMA gegenüber dem Scratch Assay in Bezug auf Reproduzierbarkeit und Integrität der ECM.
Erfahren Sie mehr über Oris Zellmigrations-Assays.