オリス細胞移動アッセイとスクラッチアッセイの比較
細胞移動は、胚発生、組織再生、創傷治癒など、多くの生理学的プロセスに不可欠である。 加えて 細胞遊走は腫瘍転移と動脈硬化に関与する.細胞遊走の研究によく使われるアッセイの1つ インビトロ はスクラッチ・アッセイである。 スクラッチアッセイは、コンフルエントな細胞単層膜上に無細胞の隙間、すなわち「スクラッチ」を作り、開口部の端にある細胞が内側に移動してスクラッチを閉じることで行われる。 細胞遊走は、スクラッチ形成の開始時と、スクラッチ閉鎖中にユーザー定義の間隔で撮影した画像を比較することで評価できる。 スクラッチアッセイは簡単に実施でき、安価である。 しかしながら、スクラッチ形成の方法は研究室によって様々であり、結果は非常にばらつきがある。 さらに、スクラッチ形成の過程では、以下のことが示されている。 細胞外マトリックスに損傷を与える (ECM)。
オリスの細胞遊走アッセイ(CMA)は、スクラッチアッセイ の限界に対処するためにデザインされた。 オリスCMA(図1)は、ウェルの中央の検出ゾーンから 細胞を排除するシリコン製ストッパーを備えた96ウェルプ レートを使用する。 細胞を播種し接着させた後、シリコン製ストッパーを外すと、各ウェルの中央に播種されていない領域が現れ、そこに細胞が移動する。 オリスCMAでは、検出ゾーンのサイズが均一であるため、スクラッチアッセイに比べてアッセイの再現性が高く、下層のECMはシリコンストッパーによって損傷されません。
このアプリケーションノートでは、細胞遊走の評価において、オリスCMAとスクラッチアッセイを直接比較しています。 さらに、ECMの完全性は両方のアッセイフォーマットで評価されます。
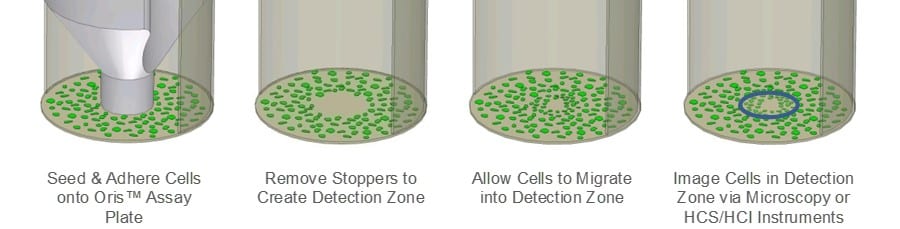
材料と方法
オリスCMAとスクラッチアッセイのすべての工程は、同じ日に並行して行われた。
オリス細胞移動アッセイ: 96ウェルOris TCプレートの各ウェルに9μg/mLコラーゲンI(Trevigen)をコートし、37℃で一晩インキュベートした。oC/5%CO2. インキュベーション後、ウェルを洗浄し、Oris Cell Seeding Stoppersのストッパーを外したものを挿入した。 MDA-MB-231ヒト乳房上皮細胞(25,000細胞/100µL)をオリスアッセイプレートの全てのテストウェルに播種した。 コンフルエントな単層が形成されたら、細胞を24時間血清飢餓状態にし、ストッパーを外し、培地を血清含有培地に交換した。 ストッパーを外した直後、Zeiss Axiovert顕微鏡と付属のCCDカメラを用いて位相画像を撮影し、細胞のない検出ゾーンの遊走前領域を記録した。 その後、オリスアッセイプレートを37℃に保った。oC/5% CO2 細胞の移動を可能にする。
スクラッチ・アッセイ: Costar® 6ウェルプレートの各ウェルに9μg/mLコラーゲンI(Trevigen)をコートし、37℃で一晩インキュベートした。oC/5% CO2. インキュベーション後、ウェルを洗浄し、MDA-MB-231細胞(50万個/2mL)をCostar®プレートの各ウェルに播種した。 コンフルエントな単層が形成された後、細胞を24時間血清欠乏させ、1000µLのピペットチップを用いて細胞単層をスクラッチし、血清を含む培地を各ウェルに添加した。 シャープペンシルのマーカーを使い、各ウェルのスクラッチ付近に基準点を作り、各スクラッチの位相画像を撮影し、細胞のない検出ゾーンの遊走前領域を記録した。 オリスアッセイプレートと並行して、スクラッチアッセイプレートを37℃に保った。oC/5% CO2 細胞の移動を可能にする。
24時間後、オリスアッセイプレートとスクラッチアッセイプレートのテストウェルを0.25%グルタルアルデヒドで固定した。 遊走時点を記録するために、両方のアッセイで位相画像を撮影した。 基準点を用いて、遊走前画像と同じスクラッチ領域を撮像した。 両方のアッセイ形式において、細胞遊走は、遊走前と対応する遊走時 点における検出ゾーンの面積を測定することにより評価した。 イメージジェイ v1.42l解析ソフトウェア。 細胞遊走は、以下の式で計算した閉鎖率で表示される:
(移行前エリア - 移住エリア ) x 100 / (移住前)エリア
ECM完全性アッセイ: 各アッセイでECMの完全性を調べるため、100μg/mLのコラーゲンタイプI-FITC結合体(シグマアルドリッチ)をオリスアッセイプレート(ストッパーなし)およびコスター®プレートのウェルにコートし、37℃で一晩インキュベートした。oC/5% CO2. インキュベーション後、ストッパーをオリスアッセイプレートに挿入し、滅菌したPBSを両方のアッセイプレートのウェルに加えた。 挿入から1時間後、24時間後、48時間後にストッパーを外し、Zeiss Axiovert倒立顕微鏡を用いて蛍光画像を撮影した。 前述の各時点で、Costar® プレートに傷をつけ、オリスアッセイプレートに用いたのと同じ設定で画像を撮影した。
結果
MDA-MB-231細胞の移動は、オリスCMAとスクラッチアッセイという2つの異なる移動アッセイを用いて、コラーゲンIでコーティングされた表面上で比較された。 各アッセイの性能を比較するため、異なる日に4つの別々の実験を並行して行った。 それぞれの独立した実験において、オリスCMA(図2AおよびB)を用いて達成された平均面積閉鎖は87%-89%の範囲であり、分散係数は3.7-6.5%であった(図2E)。 逆に、スクラッチアッセイ(図2CとD)を用いて得られた平均閉塞面積は69%-77%で、分散係数は11.3-25.6%であった(図2E)。 これらの結果は、スクラッチアッセイで得られた結果と比較して、オリスCMAはより再現性の高い、実験間でより一貫した結果をもたらすことを示している。
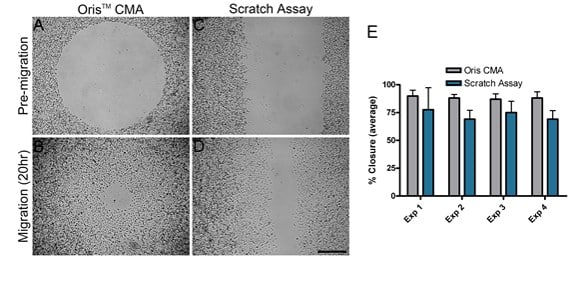
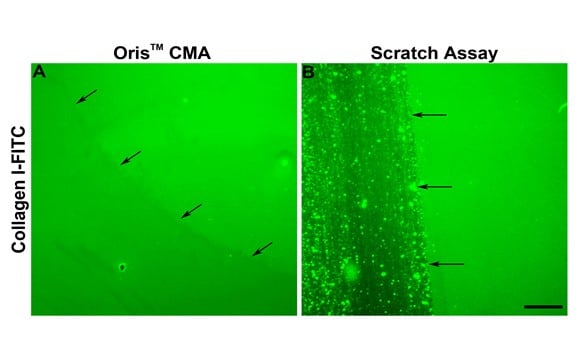
図2Eに示すように、スクラッチアッセイでの細胞遊走は、オリスアッセイで観察されたものより一貫して少なかった。 スクラッチアッセイで細胞遊走が減少した理由のひとつ は、スクラッチ形成時にECMが損傷したためかもしれな い。 Kamら(2008)は、スクラッチ形成時にECMが 損傷する可能性があることを示した。本研究でこのことが当てはまるかどうかを評価 するため、ストッパーを外し、スクラッチ形成後のコラーゲ ン被膜の完全性を評価した。 オリスCell Seeding Stopperはコラーゲ ン被膜に悪影響を与えなかった。 逆に、FITC標識コラーゲンIでコーティングしたアッセイプレートを用いると、スクラッチ形成の過程でコラーゲン被膜が損傷し、発表された知見と一致した(図3B)。これらの結果は、下層のコラーゲン被膜の損傷が、スクラッチアッセイで観察された細胞遊走の減少に関与している可能性を示唆している。
結論
このアプリケーションノートでは、オリスの細胞移動アッセイと一般的に用いられているスクラッチアッセイの性能を比較しています。 この研究の結果、オリスCMAはスクラッチアッセイと比較して、実験間でより一貫した結果を得ることができ、再現性が高いことが実証されました。 また、スクラッチアッセイにおける機械的スクラッチ形成とは対照的に、オリスCMAにおけるシリコンストッパーの使用は、その下のECMにダメージを与えない。 これらの結果を総合すると、ECMの再現性と完全性に関して、スクラッチアッセイよりもオリスCMAの方が優れていることがわかる。
詳細はこちら オリス細胞移動アッセイ.