奥利斯细胞迁移试验与划痕试验的比较
细胞迁移与胚胎发育、组织再生和伤口愈合等许多生理过程密不可分。 此外 细胞迁移与肿瘤转移和动脉粥样硬化有关.一种常用于研究细胞迁移的检测方法是 体外 即划痕试验。 划痕试验是在汇合的细胞单层上形成一个无细胞间隙或 "划痕",开口边缘的细胞向内移动以关闭划痕。 细胞迁移可通过比较划痕形成之初和划痕闭合过程中用户定义的时间间隔所捕获的图像进行评估。 划痕实验操作简单,成本低廉。 然而,不同实验室的划痕形成方法各不相同,结果也会有很大差异。 此外,划痕形成的过程已被证明可以 破坏下层细胞外基质 (ECM)。
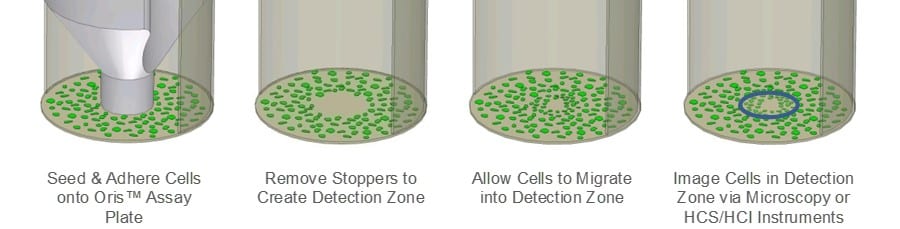
Oris 细胞迁移分析法(CMA)旨在解决划痕分析法的局限性。 Oris CMA(图 1)使用 96 孔板,板上装有硅胶塞,可将细胞排除在孔中央检测区之外。 细胞播种并附着后,取下硅胶塞,露出每个孔中央的未播种区,允许细胞迁移到该区域。 由于检测区大小一致,而且硅胶塞不会破坏底层的 ECM,因此 Oris CMA 的检测重现性比划痕检测更高。
本应用说明对 Oris CMA 和划痕试验在评估细胞迁移方面进行了直接比较。 此外,两种检测方法均可评估 ECM 的完整性。
材料与方法
奥利斯 CMA 和划痕检测的所有步骤都在同一天同时进行。
奥利斯细胞迁移试验: 在 96 孔 Oris TC 板的每个孔中涂布 9µg/mL 胶原 I(Trevigen),并在 37°C 下培养过夜。oC/5%CO2. 培养结束后,冲洗测试孔,然后插入已移除塞子的 Oris 细胞播种塞。 将 MDA-MB-231 人类乳腺上皮细胞(25,000 个细胞/100µL)播种到 Oris 检测板的所有测试孔中。 一旦形成汇合的单层细胞,将细胞进行 24 小时血清静置,移除塞子,换上含血清的培养基。 取下塞子后,立即使用带有 CCD 相机的 Zeiss Axiovert 显微镜拍摄相位图像,记录无细胞检测区的预迁移区域。 然后将 Oris 检测板置于 37oC/5% CO2 以允许细胞迁移。
划痕检测: Costar® 6 孔板的每个孔都涂有 9µg/mL 胶原 I(Trevigen),并在 37°C 下培养过夜。oC/5% CO2. 培养后,冲洗孔,将 MDA-MB-231 细胞(500,000 个细胞/2 毫升)接种到 Costar® 板的每个孔中。 形成汇合单层后,将细胞血清饥饿 24 小时,然后用 1000µL 移液管吸头刮擦细胞单层,并在每个孔中加入含血清的培养基。 用锐利的记号笔在每个孔的划痕附近创建一个参考点,然后捕捉每个划痕的相位图像,记录无细胞检测区的预迁移区域。 与奥利斯检测板同时,将划痕检测板放置在 37oC/5% CO2 以允许细胞迁移。
24 小时后,用 0.25% 戊二醛固定奥利斯检测板和划痕检测板的测试孔。 在两种检测中都拍摄了相位图像,以记录迁移时间点。 以迁移前图像中划痕的相同区域为参考点进行成像。 在这两种检测方法中,细胞迁移都是通过测量迁移前和相应迁移时间点的检测区面积来评估的。 图像 J v1.42l 分析软件。 细胞迁移以闭合百分比表示,计算公式如下:
(移民前地区 - (移民)地区 ) x 100 / (迁移前)地区
ECM 完整性检测: 为了在每种试验中检测 ECM 的完整性,将 100µg/mL 的 I 型胶原 - FITC 结合物(Sigma-Aldrich)涂布到 Oris 检测板(无塞子)和 Costar® 板的孔中,并在 37°C 下培养过夜。oC/5% CO2. 培养后,将塞子塞入奥利斯检测板,并在两个检测板的孔中加入无菌 PBS。 插入后 1 小时、24 小时和 48 小时,取出塞子,使用 Zeiss Axiovert 倒置显微镜捕捉荧光图像。 在上述每个时间点,在 Costar® 板上划痕,并使用与 Oris 检测板相同的设置捕获图像。
成果
使用两种不同的迁移试验:Oris CMA 和划痕试验,比较了 MDA-MB-231 细胞在涂有胶原 I 的表面上的迁移情况。 在不同的日期平行进行了四次实验,以比较每种检测方法的性能。 在每个独立实验中,使用 Oris CMA(图 2A 和 B)获得的平均闭合面积在 87%-89% 之间,方差系数在 3.7-6.5% 之间(图 2E)。 相反,使用划痕检测(图 2C 和 D)获得的平均闭合面积范围为 69%-77%,方差系数在 11.3-25.6% 之间(图 2E)。 这些结果表明,与使用划痕检测法得出的结果相比,Oris CMA 在不同实验中得出的结果更加一致,可重复性更高。
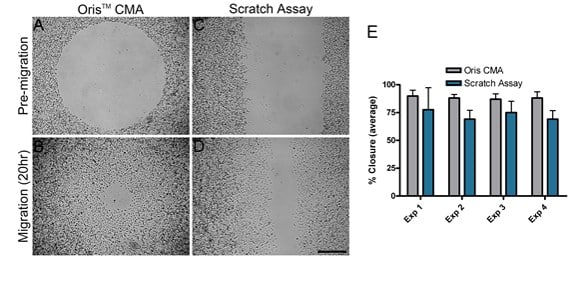
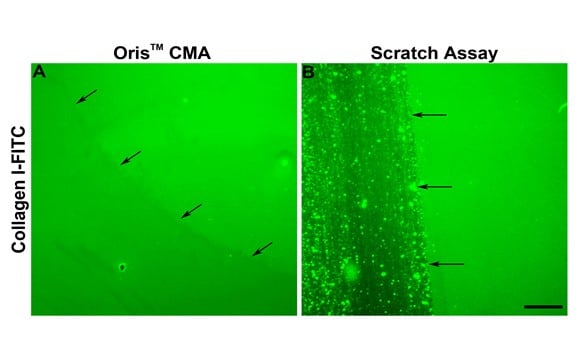
如图 2E 所示,划痕试验中的细胞迁移始终少于奥利斯试验中观察到的细胞迁移。 划痕试验中细胞迁移量减少的原因之一可能是划痕形成过程中对 ECM 造成了破坏。 Kam 等人(2008 年)证实,划痕形成过程中 ECM 可能会受损。为了评估本研究中的情况是否属实,我们评估了塞子移除和划痕形成后胶原蛋白涂层的完整性。 如整个图像区域均匀的荧光所示,Oris 细胞种植塞没有对胶原蛋白涂层造成不利影响(图 3A)。 相反,使用涂有 FITC 标记的胶原 I 的检测板时,划痕的形成过程会破坏胶原涂层,这与已发表的研究结果一致(图 3B)。这些结果表明,底层胶原蛋白涂层受损可能是划痕试验观察到的细胞迁移减少的原因。
结论
本应用说明比较了 Oris 细胞迁移检测法与常用的划痕检测法的性能。 研究结果表明,与划痕法相比,Oris CMA 可使实验结果更加一致,重现性更高。 此外,与划痕试验中的机械划痕形成不同,Oris CMA 中使用的硅胶塞不会损坏底层 ECM。 总之,这些结果说明了 Oris CMA 在重现性和 ECM 的完整性方面优于划痕试验。
了解更多 奥利斯细胞迁移试验.