Comparación del ensayo de migración celular de Oris con el ensayo de raspado
La migración celular forma parte integral de muchos procesos fisiológicos, como el desarrollo embrionario, la regeneración de tejidos y la cicatrización de heridas. Además, la migración celular interviene en la metástasis tumoral y la aterosclerosis. Un ensayo comúnmente utilizado para estudiar la migración celular in vitro es el ensayo del rasguño. El ensayo del rasguño se realiza creando un hueco libre de células, o "rasguño", en una monocapa celular confluente sobre la que las células del borde de la abertura se mueven hacia dentro para cerrar el rasguño. La migración celular puede evaluarse comparando las imágenes capturadas al inicio de la creación del arañazo y a intervalos definidos por el usuario durante el cierre del arañazo. El ensayo del arañazo es fácil de realizar y barato. Sin embargo, los métodos para crear el arañazo varían de un laboratorio a otro y los resultados pueden ser muy variables. Además, se ha demostrado que el proceso de formación del arañazo dañar la matriz extracelular subyacente (ECM).
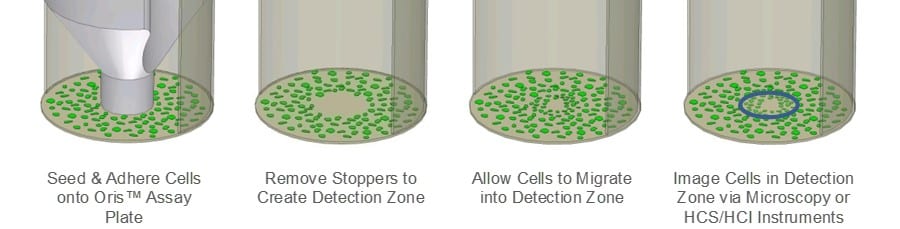
El ensayo de migración celular de Oris (CMA) se diseñó para abordar las limitaciones del ensayo de raspado. El Oris CMA (Figura 1) utiliza una placa de 96 pocillos con tapones de silicona que excluyen las células de la zona de detección central del pocillo. Después de sembrar las células y dejar que se adhieran, se retiran los tapones de silicona para dejar al descubierto una región no sembrada en el centro de cada pocillo, a la que se permite migrar a las células. La reproducibilidad del ensayo es mayor en el Oris CMA en comparación con el ensayo de raspado como resultado del tamaño uniforme de las zonas de detección, y el tapón de silicona no daña la MEC subyacente.
Esta nota de aplicación ofrece una comparación directa entre el ensayo Oris CMA y el ensayo scratch para evaluar la migración celular. Además, la integridad de la ECM se evalúa en ambos formatos de ensayo.
Materiales y métodos
Todos los pasos para el Oris CMA y el ensayo de raspado se realizaron en paralelo el mismo día.
Ensayo de migración celular Oris: Cada pocillo de una placa Oris TC de 96 pocillos se recubrió con 9µg/mL de colágeno I (Trevigen) y se incubó durante la noche a 37oC/5%CO2. Tras la incubación, se enjuagaron los pocillos y se insertaron los tapones Oris Cell Seeding Stoppers retirados. Se sembraron células epiteliales de mama humana MDA-MB-231 (25.000 células/100µL) en todos los pocillos de ensayo de la placa de ensayo Oris. Una vez formada la monocapa confluente, se privó a las células de suero durante 24 horas, se retiraron los tapones y se sustituyó el medio por otro que contuviera suero. Inmediatamente después de retirar los tapones, se tomaron imágenes de fase con un microscopio Zeiss Axiovert provisto de una cámara CCD para documentar el área de premigración de la zona de detección libre de células. A continuación, se colocó la placa de ensayo Oris a 37oC/5% CO2 para permitir la migración celular.
Ensayo de raspado: Cada pocillo de una placa Costar® de 6 pocillos se recubrió con 9µg/mL de colágeno I (Trevigen) y se incubó durante la noche a 37oC/5% CO2. Tras la incubación, se enjuagaron los pocillos y se sembraron células MDA-MB-231 (500.000 células/2mL) en cada pocillo de la placa Costar®. Una vez formada la monocapa confluente, se privó a las células de suero durante 24 horas y, a continuación, se rascaron las monocapas celulares con una punta de pipeta de 1000 µl y se añadió medio con suero a cada pocillo. Se utilizó un rotulador sharpie para crear un punto de referencia cerca del rasguño en cada pocillo y se capturaron imágenes de fase de cada rasguño para documentar el área de premigración de la zona de detección libre de células. Paralelamente a la placa de ensayo Oris, la placa de ensayo de rayado se colocó a 37oC/5% CO2 para permitir la migración celular.
Transcurridas 24 horas, los pocillos de ensayo tanto de la placa de ensayo Oris como de la placa de ensayo scratch se fijaron con glutaraldehído 0,25%. Se capturaron imágenes de fase en ambos ensayos para documentar los puntos temporales de migración. Se utilizó como punto de referencia la misma región del arañazo de la imagen previa a la migración. En ambos formatos de ensayo, la migración celular se evaluó midiendo el área de la Zona de Detección en los puntos temporales de premigración y migración correspondiente utilizando ImageJ v1.42l. La migración celular se presenta como porcentaje de cierre, calculado mediante la siguiente ecuación:
((Antes de la migración)zona - (Migración)zona ) x 100 / (Antes de la migración)zona
Ensayo de integridad de la MEC: Para comprobar la integridad de la ECM en cada ensayo, se recubrieron 100µg/mL de colágeno tipo I - conjugado FITC (Sigma-Aldrich) en pocillos de una placa de ensayo Oris (sin tapones) y una placa Costar®, y se incubaron durante la noche a 37oC/5% CO2. Tras la incubación, se insertaron tapones en la placa de ensayo Oris y se añadió PBS estéril a los pocillos de ambas placas de ensayo. Una hora, 24 horas y 48 horas después de la inserción, se retiraron los tapones y se obtuvieron imágenes de fluorescencia con un microscopio invertido Zeiss Axiovert. En cada uno de los puntos temporales mencionados, se hicieron rasguños en la placa Costar® y se capturaron imágenes con los mismos ajustes que los utilizados para la placa de ensayo Oris.
Resultados
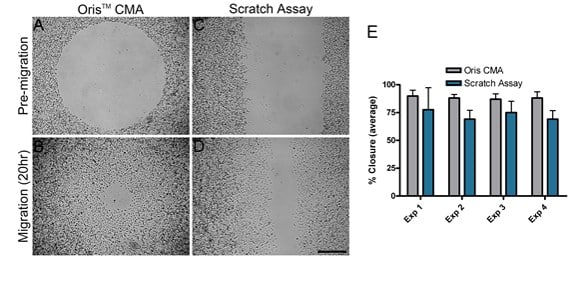
Se comparó la migración de células MDA-MB-231 sobre superficies recubiertas de colágeno I utilizando dos ensayos de migración diferentes: el Oris CMA y el ensayo de rascado. Se realizaron cuatro experimentos distintos en paralelo en días diferentes para comparar el rendimiento de cada ensayo. En cada experimento independiente, el cierre medio del área obtenido utilizando el Oris CMA (Figura 2A y B) osciló entre 87%-89% con un coeficiente de varianza entre 3,7-6,5% (Figura 2E). Por el contrario, el cierre de área medio obtenido mediante el ensayo de rayado (Figura 2C y D) osciló entre 69%-77% con un coeficiente de varianza entre 11,3-25,6% (Figura 2E). Estos resultados demuestran que el Oris CMA produce resultados más consistentes entre los experimentos con una mayor reproducibilidad en comparación con los resultados obtenidos utilizando el ensayo de raspado.
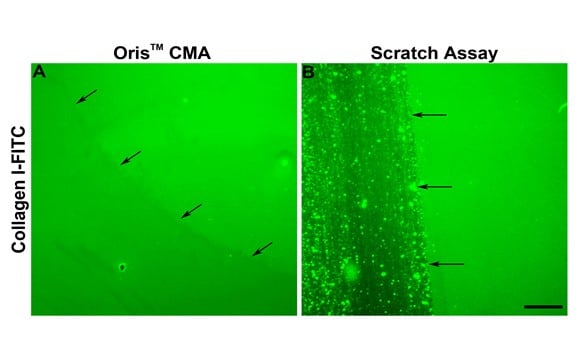
Como se indica en la Figura 2E, la migración celular en el ensayo de rayado fue sistemáticamente inferior a la observada en el ensayo Oris. Una de las razones de la disminución de la migración celular en el ensayo de rayado puede deberse al daño causado a la MEC durante la formación del rayado. Kam et al. (2008) demostraron que la MEC puede dañarse durante la formación del arañazo. Para evaluar si esto podría ser cierto en este estudio, se evaluó la integridad del revestimiento de colágeno tras la retirada del tapón y la formación del arañazo. El Oris Cell Seeding Stopper no afectó negativamente al recubrimiento de colágeno, como indica la fluorescencia uniforme en todo el campo de imagen (Figura 3A). Por el contrario, utilizando placas de ensayo recubiertas con colágeno I marcado con FITC, el proceso de formación de arañazos dañó el recubrimiento de colágeno, de acuerdo con los resultados publicados (Figura 3B). Estos resultados sugieren que el daño al recubrimiento de colágeno subyacente puede contribuir a la reducción de la migración celular observada mediante el ensayo de rayado.
Conclusiones
Esta nota de aplicación compara el rendimiento del ensayo de migración celular Oris con el ensayo de raspado comúnmente utilizado. Los resultados de este estudio demuestran que el Oris CMA permite obtener resultados más consistentes entre experimentos con una mayor reproducibilidad en comparación con el ensayo de rayado. Además, a diferencia de la formación de arañazos mecánicos en el ensayo del arañazo, el uso de un tapón de silicona en el Oris CMA no daña la ECM subyacente. En conjunto, estos resultados ilustran las ventajas del Oris CMA sobre el ensayo de rascado en lo que respecta a la reproducibilidad y la integridad de la MEC.
Más información Ensayos de migración celular Oris.