Comparaison de l'essai de migration cellulaire Oris avec l'essai Scratch
La migration cellulaire fait partie intégrante de nombreux processus physiologiques, notamment le développement embryonnaire, la régénération des tissus et la cicatrisation des plaies. En outre, la migration cellulaire est impliquée dans les métastases tumorales et l'athérosclérose. Un test couramment utilisé pour étudier la migration cellulaire in vitro est le test de l'égratignure. Ce test consiste à créer un espace sans cellule, ou "rayure", sur une monocouche de cellules confluentes, sur laquelle les cellules situées au bord de l'ouverture se déplacent vers l'intérieur pour refermer la rayure. La migration cellulaire peut être évaluée en comparant les images capturées au début de la création de la rayure et à des intervalles définis par l'utilisateur pendant la fermeture de la rayure. Le test de l'éraflure est simple à réaliser et peu coûteux. Cependant, les méthodes de création de l'éraflure varient d'un laboratoire à l'autre et les résultats peuvent être très variables. En outre, il a été démontré que le processus de formation de l'éraflure endommager la matrice extracellulaire sous-jacente (ECM).
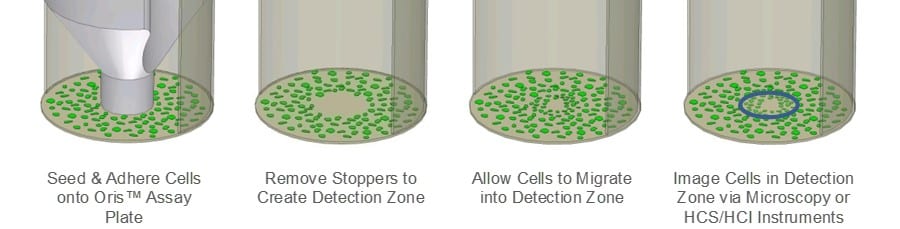
Le test de migration cellulaire (CMA) d'Oris a été conçu pour pallier les limites du test de grattage. Le CMA d'Oris (figure 1) utilise une plaque à 96 puits garnie de bouchons en silicone qui excluent les cellules de la zone de détection centrale du puits. Une fois les cellules ensemencées et autorisées à adhérer, les bouchons en silicone sont retirés pour révéler une région non ensemencée au centre de chaque puits, dans laquelle les cellules sont autorisées à migrer. La reproductibilité de l'essai est plus grande avec l'Oris CMA qu'avec l'essai de grattage en raison de la taille uniforme des zones de détection, et l'ECM sous-jacente n'est pas endommagée par le bouchon de silicone.
Cette note d'application propose une comparaison directe entre le CMA d'Oris et le scratch assay pour l'évaluation de la migration cellulaire. En outre, l'intégrité de l'ECM est évaluée dans les deux formats d'essai.
Matériels et méthodes
Toutes les étapes de l'Oris CMA et du scratch assay ont été réalisées en parallèle le même jour.
Essai de migration cellulaire Oris: Chaque puits d'une plaque Oris TC de 96 puits a été recouvert de 9µg/mL de collagène I (Trevigen) et incubé pendant une nuit à 37oC/5%CO2. Après incubation, les puits ont été rincés et les bouchons Oris Cell Seeding Stoppers retirés. Des cellules épithéliales mammaires humaines MDA-MB-231 (25 000 cellules/100µL) ont été ensemencées dans tous les puits de la plaque d'essai Oris. Une fois la monocouche confluente formée, les cellules ont été privées de sérum pendant 24 heures, les bouchons ont été retirés et le milieu a été remplacé par un milieu contenant du sérum. Des images de phase ont été prises à l'aide d'un microscope Zeiss Axiovert équipé d'une caméra CCD, immédiatement après le retrait du bouchon, afin de documenter la zone de pré-migration de la zone de détection exempte de cellules. La plaque d'essai Oris a ensuite été placée à 37oC/5% CO2 pour permettre la migration des cellules.
Scratch Assay : Chaque puits d'une plaque Costar® à 6 puits a été recouvert de 9µg/mL de collagène I (Trevigen) et incubé pendant une nuit à 37oC/5% CO2. Après incubation, les puits ont été rincés et des cellules MDA-MB-231 (500 000 cellules/2mL) ont été ensemencées dans chaque puits de la plaque Costar®. Une fois la monocouche confluente formée, les cellules ont été privées de sérum pendant 24 heures, puis les monocouches de cellules ont été grattées à l'aide d'une pointe de pipette de 1000µL, et du milieu contenant du sérum a été ajouté à chaque puits. Un marqueur sharpie a été utilisé pour créer un point de référence près de la rayure dans chaque puits, et des images de phase ont été capturées de chaque rayure pour documenter la zone de pré-migration de la zone de détection sans cellules. Parallèlement à la plaque d'essai Oris, la plaque d'essai scratch a été placée à 37oC/5% CO2 pour permettre la migration des cellules.
Après 24 heures, les puits de test de la plaque d'essai Oris et de la plaque d'essai scratch ont été fixés avec 0,25% de glutaraldéhyde. Des images de phase ont été capturées dans les deux essais pour documenter les points temporels de migration. En guise de point de référence, la même région de l'égratignure de l'image de pré-migration a été imagée. Dans les deux formats d'essai, la migration des cellules a été évaluée en mesurant la surface de la zone de détection au moment de la pré-migration et au moment de la migration correspondante à l'aide de la méthode ImageJ v1.42l. La migration cellulaire est présentée en pourcentage de fermeture, calculée à l'aide de l'équation suivante :
((Pré-migration)zone - (Migration)zone ) x 100 / (Pré-migration)zone
Test d'intégrité de l'ECM : Pour tester l'intégrité de la MEC dans chaque essai, 100µg/mL de collagène de type I - conjugué FITC (Sigma-Aldrich) ont été déposés sur les puits d'une plaque d'essai Oris (en l'absence de bouchons) et d'une plaque Costar®, et incubés pendant une nuit à 37oC/5% CO2. Après incubation, des bouchons ont été insérés dans la plaque d'essai Oris et du PBS stérile a été ajouté aux puits des deux plaques d'essai. Une heure, 24 heures et 48 heures après l'insertion, les bouchons ont été retirés et des images de fluorescence ont été prises à l'aide d'un microscope inversé Zeiss Axiovert. À chaque point de temps susmentionné, des rayures ont été faites dans la plaque Costar® et les images ont été capturées en utilisant les mêmes paramètres que ceux utilisés pour la plaque d'essai Oris.
Résultats
La migration des cellules MDA-MB-231 a été comparée sur des surfaces revêtues de collagène I à l'aide de deux tests de migration différents : le test Oris CMA et le test de grattage. Quatre expériences distinctes ont été réalisées en parallèle à des jours différents pour comparer les performances de chaque test. Pour chaque expérience indépendante, la fermeture moyenne de la surface obtenue à l'aide de l'Oris CMA (figures 2A et B) était comprise entre 87% et 89%, avec un coefficient de variance compris entre 3,7 et 6,5% (figure 2E). Inversement, la fermeture moyenne de la zone obtenue à l'aide du test de grattage (figure 2C et D) était comprise entre 69% et 77%, avec un coefficient de variance compris entre 11,3 et 25,6% (figure 2E). Ces résultats démontrent que le CMA d'Oris donne des résultats plus cohérents d'une expérience à l'autre, avec une plus grande reproductibilité par rapport aux résultats obtenus à l'aide du scratch assay.
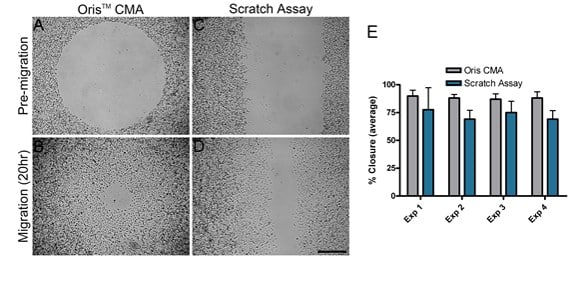
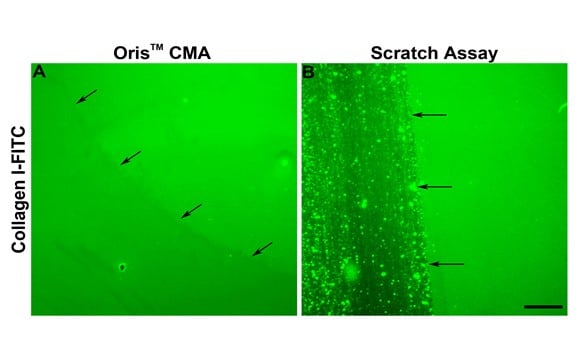
Comme l'indique la figure 2E, la migration cellulaire dans le test de grattage était systématiquement inférieure à celle observée dans le test Oris. L'une des raisons de la diminution de la migration cellulaire dans le test de grattage peut être due aux dommages causés à l'ECM pendant la formation du grattage. Kam et al. (2008) ont démontré que l'ECM peut être endommagée lors de la formation d'une égratignure. Pour déterminer si cela est vrai dans cette étude, l'intégrité du revêtement de collagène a été évaluée après le retrait du bouchon et la formation d'une rayure. L'Oris Cell Seeding Stopper n'a pas affecté négativement le revêtement de collagène, comme l'indique la fluorescence uniforme dans le champ de l'image (Figure 3A). Inversement, en utilisant des plaques d'essai recouvertes de collagène I marqué au FITC, le processus de formation de rayures a endommagé le revêtement de collagène, conformément aux résultats publiés (figure 3B). Ces résultats suggèrent que l'endommagement du revêtement de collagène sous-jacent peut contribuer à la réduction de la migration cellulaire observée lors de l'essai de grattage.
Conclusions
Cette note d'application compare les performances du test de migration cellulaire d'Oris à celles du test de grattage couramment utilisé. Les résultats de cette étude démontrent que le CMA d'Oris permet d'obtenir des résultats plus cohérents d'une expérience à l'autre et une plus grande reproductibilité par rapport au test de grattage. De plus, contrairement à la formation d'une égratignure mécanique dans le test d'égratignure, l'utilisation d'un bouchon en silicone dans le CMA d'Oris n'endommage pas l'ECM sous-jacente. Collectivement, ces résultats illustrent les avantages de la CMA d'Oris par rapport à l'essai par rayures en ce qui concerne la reproductibilité et l'intégrité de l'ECM.
En savoir plus sur Essais de migration cellulaire Oris.