Comptage des cellules dans les essais de migration avec ImageJ
Cette note d'application décrit une méthode pour mesurer la migration cellulaire, en utilisant ImageJ, en comptant le nombre de cellules qui ont migré dans la zone de détection dans un essai de migration cellulaire Oris. ImageJ est un logiciel gratuit d'analyse d'images développé par les National Institutes of Health.
La migration cellulaire est essentielle pour de nombreux événements physiologiques, notamment le développement embryonnaire, la cicatrisation des plaies et la réponse inflammatoire. En outre, le comportement mobile aberrant des cellules contribue à des processus pathologiques tels que les métastases tumorales et l'arthrite (1).
Les Essai de migration cellulaire Oris (Figure 1) utilise une plaque à 96 puits garnie de bouchons en silicone qui excluent les cellules de la zone de détection centrale du puits. Une fois les cellules ensemencées et autorisées à adhérer, les bouchons en silicone sont retirés pour révéler une région non ensemencée de 2 mm de diamètre au centre de chaque puits, dans laquelle les cellules sont autorisées à migrer.
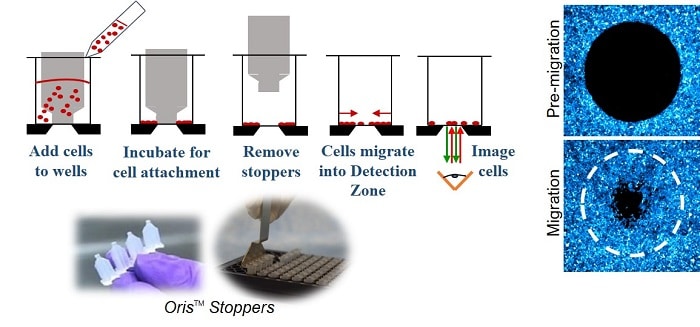
MÉTHODES
Les cellules épithéliales mammaires MDA-MB-231 et les cellules de fibrosarcome HT-1080 ont été cultivées sur une plaque TriCoated Oris™ Cell Migration Assay. ont été cultivées sur une plaque Oris™ Cell Migration Assay - TriCoated comprenant des puits traités à la culture tissulaire, recouverts de collagène I ou de fibronectine. Puits traités par culture tissulaire, enduits de collagène I ou enduits de fibronectine. Après 16 heures, les cellules ont été fixées avec 0,25% de glutaraldéhyde et les noyaux cellulaires ont été colorés avec 1:2000 de DAP. cellules ont été colorés avec du DAPI 1:2000 (Pierce). Les images ont été acquises à l'aide d'un objectif 5X sur d'un microscope inversé Zeiss Axiovert 200 équipé d'une caméra CCD.
La migration des cellules dans la zone de détection a été mesurée en comptant le nombre de cellules à l'aide du logiciel d'analyse ImageJ. en comptant le nombre de cellules à l'aide du logiciel d'analyse ImageJ (version 1.42l). Tout d'abord, le seuil a été fixé pour chaque image en niveaux de gris (Image-> Ajuster-> Seuil). En sélectionnant "Appliquer" dans la fenêtre de seuillage, l'image seuillée a été convertie en image binaire. l'image seuillée a été convertie en image binaire. Les noyaux se chevauchant légèrement superposés ont été séparés en effectuant un processus de segmentation par (Processus-> Binaire-> Bassin versant).
À partir de l'image binaire, une région d'intérêt (ROI) circulaire de 2 mm de diamètre (le même diamètre que la pointe du bouchon) a été créée. circulaire de 2 mm de diamètre (le même diamètre que l'extrémité du bouchon) a été réalisée à l'aide de la commande de menu Édition-> Sélection-> Spécifier. Dans la fenêtre "Specify", les valeurs "width" et "height" ont été fixées à 2 mm et la case "oval" a été cochée. a été cochée. Le retour sur investissement a été centré sur la zone de détection dans chaque puits. Le Le nombre de noyaux contenus dans le ROI a été quantifié à l'aide de la commande de menu Analyser-> Analyser les particules. Les valeurs pour définir la taille minimale et maximale des particules étaient respectivement de 100 et 1000 pixels2. sont respectivement de 100 et 1000 pixels2. L'option "Show Masks" a été sélectionnée pour afficher un dessin des objets détectés. des objets détectés. Les options "Summary" et "Exclude on Edges" ont été cochées pour l'analyse. l'analyse.
Les nombres de cellules de la fenêtre de résumé (c'est-à-dire les nombres) ont été exportés dans Windows Excel pour l'analyse statistique. La moyenne du nombre de noyaux pour chaque condition a été calculée à partir de 8 puits.
RÉSULTATS
Dans cette note d'application, la migration des cellules MDA-MB-231 et HT-1080 sur trois surfaces (Tissue Culture Treated, Collagen I, ou Fibronectin ; Oris™ Cell Migation Assay - TriCoated), a été évaluée en comptant le nombre de cellules dans la zone de détection à l'aide d'ImageJ. Les cellules MDA-MB-231 ont présenté des degrés variables de migration dans la zone de détection en fonction du revêtement de surface du puits (Figure 2). Les images de phase des cellules acquises immédiatement après le retrait du bouchon (contrôle de la migration) et 16 heures après le retrait du bouchon montrent des différences dans la migration des cellules selon qu'elles ont été ensemencées sur une surface traitée par culture tissulaire, une surface revêtue de collagène I ou une surface revêtue de fibronectine (Figure 2A-D).
À l'aide d'ImageJ, les cellules marquées au DAPI ont été comptées en créant une région d'intérêt (ROI) circulaire de 2 mm de diamètre, de taille similaire à la zone de détection initiale (figure 2E-H). La fonction d'analyse des particules d'ImageJ a permis d'obtenir des dessins des objets détectés qui ont été comptés dans la région d'intérêt circulaire (figure 2I-L). Les différences de migration des cellules MDA-MB-231 dans la zone de détection (ROI) ont été mises en évidence en superposant le dessin de l'analyse des particules à l'image fluorescente originale (figure 2M-P).

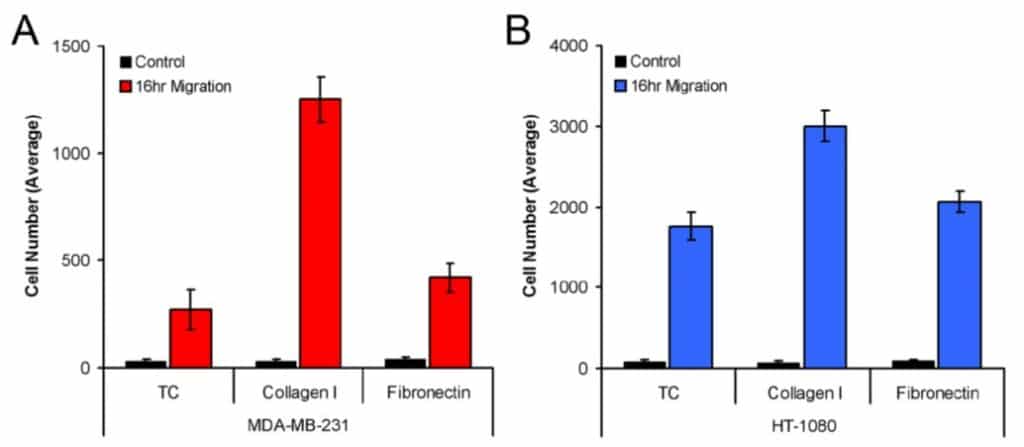
La figure 3 montre le nombre moyen de cellules MDA-MB-231 (3A) et HT-1080 (3B) qui ont migré dans la zone de détection lorsqu'elles ont été ensemencées sur des puits traités avec de la culture tissulaire, revêtus de collagène I et revêtus de fibronectine. Les cellules MDA-MB-231 et HT-1080 ont présenté la migration la plus robuste sur le collagène I. En outre, cette méthode d'analyse a produit des différences statistiques dans la migration des lignées cellulaires modèles sur les trois revêtements de plaque (c'est-à-dire la migration des cellules MDA-MB-231 sur le collagène I par rapport à la fibronectine).
CONCLUSIONS
Cette note d'application démontre une méthode de mesure de la migration cellulaire dans le test de migration cellulaire Oris™ par l'utilisation du logiciel d'analyse ImageJ pour le comptage des cellules. Cette étude, qui utilise ImageJ pour quantifier le nombre de cellules dans la zone de détection, démontre que les cellules MDA-MB-231 et HT-1080 présentent des différences de migration statistiquement significatives lorsqu'elles sont ensemencées sur des puits traités par culture tissulaire, recouverts de collagène I et recouverts de fibronectine. En utilisant la méthode d'analyse détaillée décrite ici, ImageJ peut fournir une mesure précise de la migration cellulaire lors de l'utilisation du test de migration cellulaire Oris™.
En savoir plus sur Essais de migration cellulaire Oris.