ImageJを用いた遊走アッセイにおける細胞の計数
このアプリケーションノートでは、ImageJ を用いて、オリスの細胞遊走アッセイで検出ゾーンに遊走した細胞数をカウントし、細胞遊走を測定する方法について説明します。 イメージジェイ は、米国国立衛生研究所で開発されたフリーウェアの画像解析プログラムである。
細胞の移動は、胚発生、創傷治癒、炎症反応など、多くの生理的事象に重要である。さらに、細胞の異常な運動行動は、腫瘍転移や関節炎を含む病的プロセスの一因となっている(1)。
について オリス細胞移動アッセイ (図1)96ウェルプレートは、ウェル中央の検出ゾーンから 細胞を排除するシリコン製ストッパーを備えている。細胞を播種し接着させた後、シリコン製ストッパーを外すと、各ウェルの中央に直径2mmの未播種領域が現れ、そこに細胞が移動する。
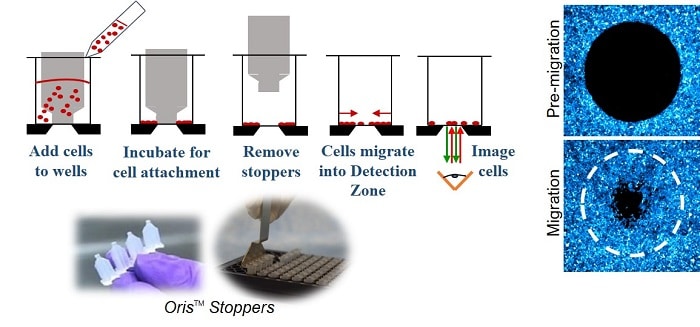
方法
MDA-MB-231 乳房上皮細胞および HT-1080 線維肉腫細胞 細胞は、Oris™ Cell Migration Assay - Tri Coated Plate(組織培養処理ウェル、コラーゲンIコートウェル、フィブロネクチンコートウェル)で培養した。 組織培養処理、コラーゲン I コート、フィブロネクチン コートの各ウエルで培養した。16時間後 16時間後、細胞を0.25%グルタルアルデヒドで固定し、細胞核を1:2000 DAP 1:2000DAPI(Pierce)で染色した。画像は CCDカメラを搭載したZeiss Axiovert 200倒立顕微鏡で、5倍の対物レンズを使用して画像を取得した。
検出ゾーンへの細胞の移動は、ImageJ解析ソフトウエアを用いて細胞数をカウントすることにより測定した。 ImageJ解析ソフトウェア(バージョン1.42l)を用いて細胞数をカウントすることにより測定した。まず 各グレイスケール画像に閾値を設定した (画像-> 調整-> しきい値).閾値ウィンドウで "Apply "を選択すると ウィンドウで "Apply "を選択すると、閾値処理された画像は2値画像に変換された。わずかに 重なっている核は、Watershedセグメンテーション処理( 処理 (プロセス-> バイナリ-> 流域).
二値画像を用いて、直径2mm(ストッパーの先端と同じ直径)の円形関心領域(ROI を作成した。 メニューコマンド 編集->選択->指定. Specify "ウィンドウで、"width "と "height "を2mmに設定し、"oval "ボックスにチェックを入れた。 をチェックした。ROI は各ウェル内の検出ゾーンの中央に設定した。ROIは各ウェル内のDetection Zoneを中心とした。 ROIに含まれる核の数は、メニューコマンド 分析-> 粒子を分析する.最小粒子径と最大粒子径はそれぞれ 粒子サイズの最小値と最大値をそれぞれ100ピクセルと1000ピクセル2とした。"マスクを表示 "を選択すると、検出されたオブジェクトの図面が表示される。 を表示する。"Summary "と "Exclude on Edges "は解析のためにチェックされた。 分析に使用した。
サマリーウィンドウの細胞数(すなわちカウント数)は、統計解析のためにWindows Excelにエクスポートした。各条件の核数は8ウェルの平均値である。
結果
本アプリケーションノートでは、3種類の表面(組織培養処理、コラーゲンⅠ、フィブロネクチン;Oris™ Cell Migation Assay - TriCoated)におけるMDA-MB-231およびHT-1080細胞の遊走を、ImageJを用いて検出ゾーン内の細胞数をカウントすることにより評価した。MDA-MB-231細胞は、ウェルの表面コーティングに依存して、検出ゾーンへの様々な程度の移動を示した(図2)。ストッパー除去直後(遊走コントロール)とストッパー除去16時間後に取得した細胞の位相像から、組織培養処理表面、コラーゲンIコート表面、フィブロネクチンコート表面のいずれに細胞を播種したかによって、細胞の遊走に違いがあることが示された(図2A-D)。
ImageJを用いて、DAPI標識細胞を、最初の検出ゾーンと同じような大きさの2mmの円形関心領域(ROI)を作ってカウントした(図2E-H)。ImageJの粒子解析機能を実行すると、円形ROI内でカウントされた検出物体の図面が得られた(図2I-L)。検出ゾーン(ROI)へのMDA-MB-231細胞の移動の違いは、粒子解析図を元の蛍光画像に重ねることで強調された(図2M-P)。

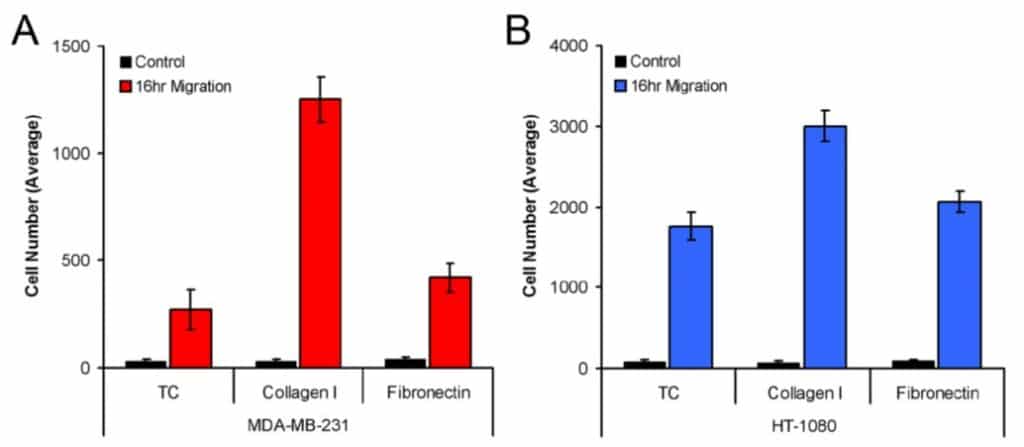
図 3 は、組織培養処理、コラーゲン I コーティング、フィブロネクチン コーティングしたウェルに播種し、検出ゾーンに遊走した MDA-MB-231 (3A) 細胞と HT-1080 (3B) 細胞の平均数を示しています。MDA-MB-231とHT-1080の両細胞は、コラーゲンI上で最も頑健な遊走を示した。さらに、この分析方法では、3種類のプレートコーティングすべてにおいて、モデル細胞株の遊走に統計的な差異が認められた(すなわち、コラーゲンI上でのMDA-MB-231の遊走とフィブロネクチン上でのMDA-MB-231の遊走)。
結論
このアプリケーションノートでは、オリス™セルマイグレーションアッセイにおいて、ImageJ解析ソフトウェアを用いて細胞数をカウントし、細胞遊走を測定する方法を示します。ImageJを用いて検出ゾーンの細胞数を定量化したこの研究では、MDA-MB-231細胞とHT-1080細胞の両方が、組織培養処理ウェル、コラーゲンⅠコートウェル、フィブロネクチンコートウェルに播種した場合、遊走において統計学的に有意な差を示したことを示しています。ここに記載された詳細な解析方法を用いることで、Oris™ Cell Migration Assayを使用する際に、ImageJは細胞遊走の正確な測定値を提供することができます。
詳細はこちら オリス細胞移動アッセイ.