Zählen von Zellen in Migrationstests mit ImageJ
Dieser Anwendungshinweis beschreibt eine Methode zur Messung der Zellmigration mit ImageJ, indem die Anzahl der Zellen gezählt wird, die in einem Oris Zellmigrationsassay in die Detektionszone gewandert sind. ImageJ ist ein kostenloses Bildanalyseprogramm, das an den National Institutes of Health entwickelt wurde.
Die Zellmigration ist für viele physiologische Vorgänge wie die Embryonalentwicklung, die Wundheilung und die Entzündungsreaktion entscheidend. Darüber hinaus trägt ein abweichendes Bewegungsverhalten von Zellen zu pathologischen Prozessen wie Tumormetastasierung und Arthritis bei (1).
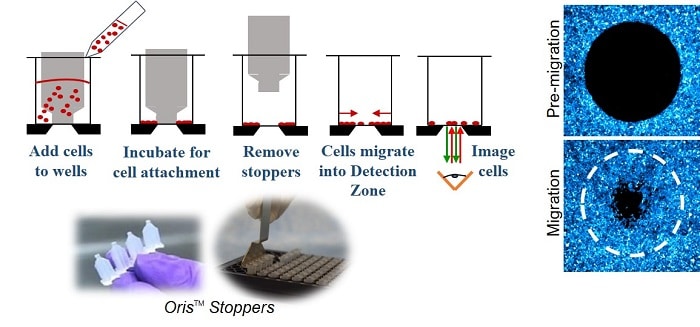
Die Oris-Zellwanderungs-Assay (Abbildung 1) wird eine Platte mit 96 Vertiefungen verwendet, die mit Silikonstopfen bestückt ist, die Zellen aus der zentralen Detektionszone der Vertiefung ausschließen. Nachdem die Zellen ausgesät wurden und anhaften konnten, werden die Silikonstopfen entfernt, so dass in der Mitte jeder Vertiefung ein unbesetzter Bereich mit einem Durchmesser von 2 mm sichtbar wird, in den die Zellen einwandern können.
METHODEN
MDA-MB-231 Brustepithelzellen und HT-1080 Fibrosarkom Zellen wurden auf einer Oris™ Cell Migration Assay - TriCoated Platte kultiviert, die Mit Gewebekultur behandelte, mit Kollagen I oder Fibronectin beschichtete Vertiefungen. Nach 16 Stunden wurden die Zellen mit 0,25% Glutaraldehyd fixiert und die Zellkerne mit mit 1:2000 DAPI (Pierce) gefärbt. Die Bilder wurden mit einem 5X-Objektiv auf einem einem Zeiss Axiovert 200 Inversmikroskop mit CCD-Kamera aufgenommen.
Die Zellmigration in die Detection Zone wurde gemessen durch Zählung der Zellzahl mit der Analysesoftware ImageJ (Version 1.42l). Zunächst wurde der Schwellenwert für jedes Graustufenbild festgelegt (Bild-> Anpassen-> Schwellenwert). Durch Auswahl von "Anwenden" im Schwellenwertfenster wurde das mit Schwellenwerten versehene Bild in ein Binärbild umgewandelt. Geringfügig überlappende Zellkerne wurden durch eine Watershed-Segmentierung Prozess (Prozess-> Binär-> Wasserscheide).
Unter Verwendung des binären Bildes wurde eine kreisförmige Region von Interesse (ROI) mit einem Durchmesser von 2 mm (demselben Durchmesser wie die Spitze des Stopfens) erstellt mit Hilfe des Menübefehls Bearbeiten-> Auswahl-> Angeben. Im Fenster "Angeben" wurden "Breite" und "Höhe" auf 2 mm eingestellt, und das Kästchen "Oval" wurde wurde markiert. Die ROI wurde über der Erkennungszone in jeder Vertiefung zentriert. Die Anzahl der in der ROI enthaltenen Zellkerne wurde mit dem Menübefehl Analysieren-> Partikel analysieren. Die Werte zur Definition der minimalen und maximalen Partikelgröße waren 100 bzw. 1000 Pixel2. Die Option "Masken anzeigen" wurde gewählt, um eine Zeichnung der der erkannten Objekte anzuzeigen. Für die Analyse wurden die Optionen "Zusammenfassung" und "An Kanten ausschließen" aktiviert. Analyse aktiviert.
Die Zellzahlen aus dem Zusammenfassungsfenster (d. h. die Zählungen) wurden zur statistischen Analyse in Windows Excel exportiert. Die Anzahl der Zellkerne für jede Bedingung wurde aus 8 Vertiefungen gemittelt.
ERGEBNISSE
In dieser Application Note wurde die Migration von MDA-MB-231- und HT-1080-Zellen auf drei Oberflächen (Tissue Culture Treated, Collagen I oder Fibronectin; Oris™ Cell Migation Assay - TriCoated) durch Zählung der Anzahl der Zellen in der Detection Zone mit ImageJ bewertet. MDA-MB-231-Zellen wandern in Abhängigkeit von der Oberflächenbeschichtung der Vertiefung in unterschiedlichem Maße in die Detection Zone (Abbildung 2). Phasenbilder von Zellen, die unmittelbar nach dem Entfernen des Stopfens (Migrationskontrolle) und 16 Stunden nach dem Entfernen des Stopfens aufgenommen wurden, zeigen Unterschiede in der Zellmigration, je nachdem, ob die Zellen auf eine mit Gewebekultur behandelte Oberfläche, eine mit Kollagen I beschichtete Oberfläche oder eine mit Fibronectin beschichtete Oberfläche ausgesät wurden (Abbildung 2A-D).
Mithilfe von ImageJ wurden DAPI-markierte Zellen gezählt, indem eine kreisförmige Region-of-Interest (ROI) mit einer Größe von 2 mm erstellt wurde, die der anfänglichen Erkennungszone ähnelt (Abbildung 2E-H). Die Durchführung der Partikelanalysefunktion in ImageJ ergab Zeichnungen der erkannten Objekte, die innerhalb der kreisförmigen ROI gezählt wurden (Abbildung 2I-L). Unterschiede in der Migration von MDA-MB-231-Zellen in die Detection Zone (ROI) wurden durch Überlagerung der Partikelanalysezeichnung mit dem ursprünglichen Fluoreszenzbild hervorgehoben (Abbildung 2M-P).

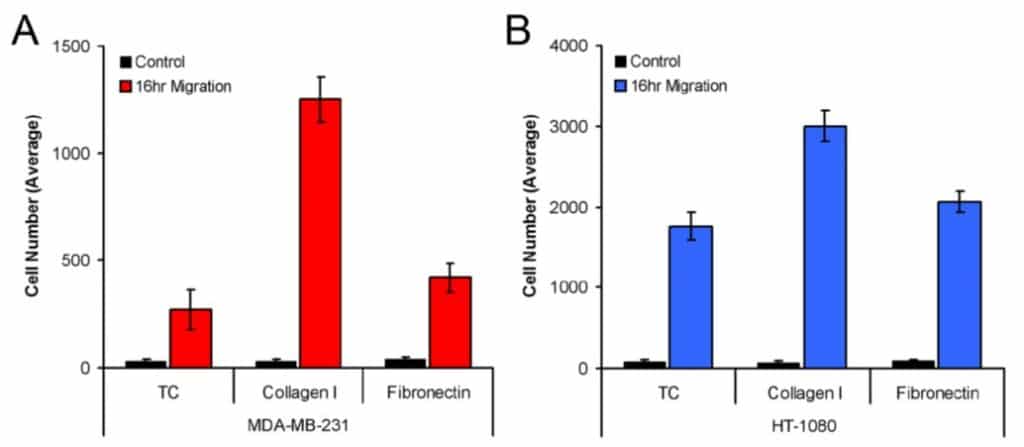
Abbildung 3 zeigt die durchschnittliche Anzahl der MDA-MB-231- (3A) und HT-1080-Zellen (3B), die in die Detektionszone migriert sind, wenn sie auf mit Gewebekultur behandelten, mit Kollagen I beschichteten und mit Fibronectin beschichteten Wells ausgesät wurden. Sowohl MDA-MB-231- als auch HT-1080-Zellen zeigten die stärkste Migration auf Collagen I. Darüber hinaus ergab diese Analysemethode statistische Unterschiede bei der Migration der Modellzelllinien auf allen drei Plattenbeschichtungen (d. h. MDA-MB-231-Migration auf Collagen I gegenüber Fibronectin).
SCHLUSSFOLGERUNGEN
Dieser Anwendungshinweis demonstriert eine Methode zur Messung der Zellmigration im Oris™ Cell Migration Assay durch die Verwendung der ImageJ-Analysesoftware zum Zählen von Zellen. Diese Studie, bei der ImageJ zur Quantifizierung der Zellzahl in der Detektionszone verwendet wird, zeigt, dass sowohl MDA-MB-231- als auch HT-1080-Zellen statistisch signifikante Unterschiede bei der Migration aufweisen, wenn sie auf mit Gewebekultur behandelte, mit Kollagen I beschichtete und mit Fibronectin beschichtete Wells ausgesät werden. Mit der hier beschriebenen detaillierten Analysemethode kann ImageJ bei Verwendung des Oris™ Cell Migration Assay eine genaue Messung der Zellmigration liefern.
Erfahren Sie mehr über Oris Zellmigrations-Assays.