ImageJ로 마이그레이션 분석에서 세포 카운팅하기
이 애플리케이션 노트에서는 ImageJ를 사용하여 Oris 세포 이동 분석에서 검출 영역으로 이동한 세포의 수를 세어 세포 이동을 측정하는 방법을 설명합니다. ImageJ 는 미국 국립보건원에서 개발한 프리웨어 이미지 분석 프로그램입니다.
세포 이동은 배아 발달, 상처 치유, 염증 반응을 포함한 많은 생리적 사건에 매우 중요합니다. 또한 세포의 비정상적인 운동 행동은 종양 전이 및 관절염을 포함한 병리학적인 과정에 기여합니다(1).
The Oris 세포 이동 분석 (그림 1)은 웰의 중앙 감지 영역에서 세포를 제외하는 실리콘 스토퍼로 채워진 96웰 플레이트를 사용합니다. 세포가 시드되고 부착되도록 허용된 후 실리콘 스토퍼를 제거하면 각 웰 중앙에 직경 2mm의 시드되지 않은 영역이 나타나며, 이 영역으로 세포가 이동하도록 허용됩니다.
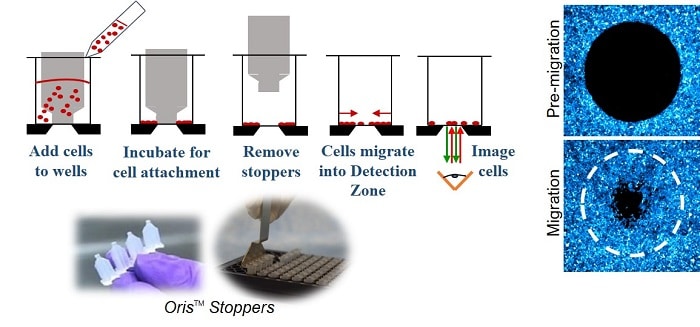
방법
MDA-MB-231 유방 상피 세포 및 HT-1080 섬유육종 세포를 Oris™ 세포 이동 분석 - 트라이코팅 플레이트에서 배양했습니다. 조직 배양 처리된 웰, 콜라겐 I 코팅 웰 또는 피브로넥틴 코팅 웰. 16시간 후 16시간 후, 세포를 0.25% 글루타르알데히드로 고정하고 세포 핵을 1:2000 DAPI(피어스)로 염색했습니다. 5배 대물렌즈를 사용하여 이미지를 획득했습니다. 5X 대물렌즈를 사용하여 이미지를 획득했습니다.
검출 영역으로의 세포 이동은 다음과 같이 측정했습니다. ImageJ 분석 소프트웨어(버전 1.42l)를 사용하여 세포 수를 계산했습니다. 먼저, 각 흑백 이미지의 임계값을 각 그레이스케일 이미지에 대해 설정했습니다(이미지-> 조정-> 임계값). 임계값 창에서 "적용"을 선택하면 창에서 "적용"을 선택하면 임계값이 적용된 이미지가 이진 이미지로 변환됩니다. 약간 겹치는 핵은 워터셰드 분할을 수행하여 분리했습니다. 프로세스(프로세스-> 바이너리-> 워터셰이드).
바이너리 이미지를 사용하여 직경 2mm의 원형 관심 영역(ROI) 직경 2mm(마개 끝과 같은 직경)의 원형 관심 영역(ROI)을 만들었습니다. 메뉴 명령을 사용하여 편집-> 선택-> 지정. 지정 창에서 '너비'와 '높이'를 2mm로 설정하고 '타원형' 상자( 을 선택했습니다. ROI는 각 유정 내의 감지 구역을 중심으로 설정되었습니다. 각 웰에 포함된 메뉴 명령을 사용하여 ROI에 포함된 핵의 수를 정량화했습니다. 분석-> 파티클 분석. 최소 및 최대 입자 크기를 정의하는 값은 입자 크기를 정의하는 값은 각각 100픽셀과 1000픽셀2입니다. "마스크 표시"를 선택하면 감지된 물체의 그림을 그림을 표시하려면 "마스크 표시"를 선택했습니다. "요약" 및 "가장자리에서 제외"를 선택했습니다. 분석.
요약 창의 세포 수(즉, 개수)는 통계 분석을 위해 Windows Excel로 내보냈습니다. 각 조건의 핵 수는 8개 웰에서 평균을 냈습니다.
결과
이 애플리케이션 노트에서는 세 가지 표면(조직 배양 처리, 콜라겐 I 또는 피브로넥틴, Oris™ 세포 이동 분석 - TriCoated)에서의 MDA-MB-231 및 HT-1080 세포 이동을 ImageJ를 사용하여 검출 영역의 세포 수를 세어 평가했습니다. MDA-MB-231 세포는 웰의 표면 코팅에 따라 검출 영역으로 이동하는 정도가 다양하게 나타났습니다(그림 2). 스토퍼 제거 직후(이동 제어) 및 스토퍼 제거 후 16시간 후에 획득한 세포의 위상 이미지는 세포가 조직 배양 처리된 표면, 콜라겐 I 코팅 표면 또는 피브로넥틴 코팅 표면에 시드되었는지 여부에 따라 세포 이동에 차이가 있음을 보여줍니다(그림 2A-D).
ImageJ를 사용하여 초기 검출 영역과 비슷한 크기의 2mm 원형 관심 영역(ROI)을 생성하여 DAPI 표지 세포를 카운트했습니다(그림 2E-H). ImageJ에서 입자 분석 기능을 수행하면 원형 ROI 내에서 카운트된 검출된 물체의 드로잉이 생성되었습니다(그림 2I-L). 원본 형광 이미지에 입자 분석 드로잉을 오버레이하여 검출 영역(ROI)으로의 MDA-MB-231 세포 이동의 차이를 강조했습니다(그림 2M-P).

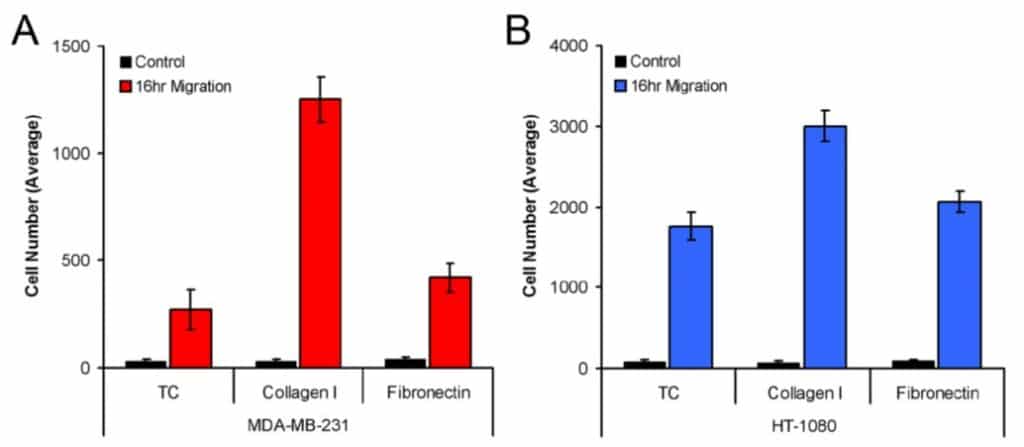
그림 3은 조직 배양 처리된 웰, 콜라겐 I 코팅 웰, 피브로넥틴 코팅 웰에 시딩했을 때 검출 영역으로 이동한 MDA-MB-231(3A) 및 HT-1080(3B) 세포의 평균 수를 보여줍니다. 또한, 이 분석 방법은 세 가지 플레이트 코팅 모두에서 모델 세포주의 이동에 통계적 차이를 나타냈습니다(즉, 콜라겐 I에 대한 MDA-MB-231의 이동과 피브로넥틴에 대한 MDA-MB-231의 이동).
결론
이 애플리케이션 노트는 세포 계수를 위한 ImageJ 분석 소프트웨어를 사용하여 Oris™ 세포 이동 분석에서 세포 이동을 측정하는 방법을 보여줍니다. ImageJ를 사용하여 검출 영역에서 세포 수를 정량화하는 이 연구에서는 조직 배양 처리된 웰, 콜라겐 I 코팅 웰, 피브로넥틴 코팅 웰에 시딩했을 때 MDA-MB-231 및 HT-1080 세포 모두 이동에서 통계적으로 유의미한 차이를 보였음을 입증합니다. 여기에 설명된 상세한 분석 방법을 사용하면 ImageJ는 Oris™ 세포 이동 분석법을 사용할 때 세포 이동을 정확하게 측정할 수 있습니다.
자세히 알아보기 Oris 세포 이동 분석.