分子结合力谱学
在原子力显微镜、力谱和质谱应用中,镀金硅基底可促进分子附着并形成自组装单层(SAM)。镀金基底的高纯度和均匀性为表征方法提供了理想的表面。
加利福尼亚大学劳伦斯利弗莫尔国家实验室进行的一项研究利用原子力显微镜 (AFM) 和聚合物系链对蛋白质和配体的结合能力进行了调查。鸭嘴兽科技公司的 镀金硅衬底 用于创建功能化表面,以便研究蛋白质和配体之间的相互作用。
研究了 concanavalin-A 蛋白(ConA)和甘露糖之间的键断裂力。选择 ConA 进行评估是因为它在碳水化合物结合中的作用。碳水化合物结合分子具有独特的化学和物理特性,可通过与配体的可控结合进行调节。配体是一种能促进与另一种分子结合的分子,被选为结合的配体是一种称为甘露糖的糖。对 ConA 和甘露糖之间断裂力的研究可用于研究疾病,促进发现新的生物进步。
力谱法用于减少生物分子的非特异性结合。分子附着在原子力显微镜悬臂上,以探测基底表面。对悬臂的偏转进行检测,以显示偏转的变化和产生键断裂所需的力。键的断裂是通过计算聚合物在接近断裂前的拉伸距离来确定的。在本实验中,结合物种附着在聚合物系绳上。
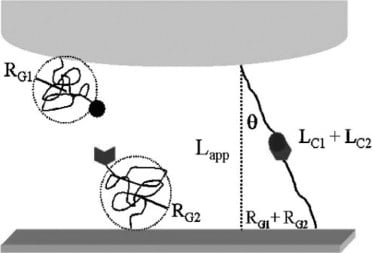
与单系系统相比,研究人员采用了双系系统。双系留系统允许蛋白质附着在原子力显微镜顶部,配体附着在金基底上。建立局部特异性和非特异性结合有助于消除非特异性结合的可能性。此外,这种方法还提高了力测量的整体准确性。
在将氮化硅悬臂浸入含有 ConA 的缓冲溶液之前,先对其进行盐析处理,以减少 AFM 针尖上活性基团的数量。然后将鸭嘴兽金涂层硅基底浸入乙醇中,生成 SAM,再将其浸入甘露糖溶液中。这样就形成了甘露糖功能化基底。
然后在系链 ConA 蛋白和甘露糖基质之间进行原子力显微镜测量。确定了三种长度尺度的粘附相互作用。
断裂力由针尖到基底的距离决定。上图 C 部分显示了 33 至 43 毫米之间蛋白质与配体的相互作用。该位置表示 ConA 与甘露糖之间的蛋白质-碳水化合物键最初断裂。该位置的长度明显增加,表明键断裂。加入甘露糖缓冲液作为蛋白质-配体键合抑制剂后,结果得到进一步证实。加入阻断剂后,先前表明的 33 至 43 毫米之间的粘合相互作用减弱,而其他区域则不受影响。
总之,原子力显微镜技术和 镀金硅衬底 在研究非特异性结合时可以提供令人鼓舞的结果。
资源