Espectroscopia de fuerzas en la unión de moléculas
Los sustratos de silicio recubiertos de oro pueden favorecer la adhesión de moléculas y dar lugar a monocapas autoensambladas (SAM) en aplicaciones de AFM, espectroscopia de fuerzas y espectroscopia de masas. La gran pureza y uniformidad de los sustratos recubiertos de oro proporcionan la superficie ideal para los métodos de caracterización.
Un estudio de investigación realizado en el Laboratorio Nacional Lawrence Livermore de la Universidad de California investigó las capacidades de unión de una proteína y un ligando utilizando microscopía de fuerza atómica (AFM) junto con ataduras poliméricas. Platypus Technologies sustratos de silicio recubiertos de oro para crear una superficie funcionalizada que permitiera el estudio de las interacciones entre proteínas y ligandos.
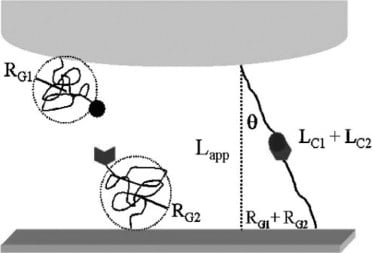
Se investigó la fuerza de ruptura del enlace entre la proteína concanavalina-A (ConA) y la manosa. La ConA fue seleccionada para la evaluación debido a su papel en la unión de carbohidratos. Las moléculas de unión a carbohidratos poseen propiedades químicas y físicas diferenciadas que pueden manipularse fácilmente mediante la unión controlada con un ligando. El ligando, una molécula que facilita la unión a otra molécula, seleccionado para la unión fue un azúcar conocido como manosa. La investigación de la fuerza de ruptura entre ConA y manosa puede utilizarse para estudiar enfermedades y promover el descubrimiento de nuevos avances biológicos.
La espectroscopia de fuerzas se utilizó para reducir la unión inespecífica de moléculas biológicas. Se fijaron moléculas a un voladizo de AFM para sondear la superficie del sustrato. Se examinó la deflexión del voladizo para indicar los cambios en la deflexión y la fuerza necesaria para crear una ruptura de enlace. La ruptura de la unión se determina calculando la distancia que se estira el polímero antes de acercarse a la ruptura. En este experimento, las especies de enlace se unieron a ataduras poliméricas.
En lugar de un sistema de fijación simple, los investigadores aplicaron un sistema de fijación doble. Este sistema permite que la proteína se fije a la parte superior del AFM y que el ligando se fije al sustrato de oro. La creación de uniones específicas y no específicas localizadas ayudó a eliminar la posibilidad de uniones no específicas. Además, este método mejora la precisión general de las mediciones de fuerza.
Los voladizos de nitruro de silicio se salinizaron para reducir el número de grupos activos en la punta del AFM antes de sumergirlos en una solución tampón que contenía ConA. A continuación, los sustratos de silicio recubiertos de oro Platypus se sumergieron en etanol para producir SAM que luego se sumergieron en la solución de manosa. De este modo, se creó un sustrato funcionalizado con manosa.
A continuación se realizaron mediciones AFM entre la proteína ConA anclada y el sustrato de manosa. Se identificaron tres escalas de longitud como interacciones adhesivas.
La fuerza de ruptura se determinó por la distancia de la punta al sustrato. La sección C de la figura anterior ilustra la interacción de la proteína y el ligando entre 33 y 43 mm. Este punto representa la ruptura inicial del enlace proteína-carbohidrato entre la ConA y la manosa. Esta localización muestra un aumento significativo de la longitud, lo que indica la ruptura del enlace. Los resultados se confirmaron además con la adición de un tampón de manosa que sirvió como inhibidor de la unión proteína-ligando. Las interacciones adhesivas indicadas anteriormente entre 33 y 43 mm disminuyeron con la adición del agente bloqueante, mientras que otras regiones no se vieron afectadas.
En conclusión, las técnicas de AFM y sustratos de silicio recubiertos de oro puede proporcionar resultados alentadores cuando se estudia la unión inespecífica.
Recursos:
Espectroscopia de fuerza del enlace manosa doblemente ligado de la Concanavalina-A - ScienceDirect