分子結合における力スペクトロスコピー
金でコーティングされたシリコン基板は、分子の付着を促進し、AFM、力顕微鏡、質量分析などのアプリケーションにおいて自己組織化単分子膜(SAM)を形成することができる。高純度で均一な金コート基板は、キャラクタリゼーション手法に理想的な表面を提供する。
カリフォルニア大学ローレンス・リバモア国立研究所で行われた研究では、原子間力顕微鏡(AFM)とポリマーテザーを用いて、タンパク質とリガンドの結合能力を調査した。プラティパス・テクノロジーズの 金メッキシリコン基板 は、タンパク質とリガンドの相互作用の研究を可能にする機能化表面を作成するために使用された。
コンカナバリンAタンパク質(ConA)とマンノースの間の結合破壊力を調べた。ConAは、糖鎖結合におけるその役割から評価対象として選ばれた。炭水化物結合分子は際立った化学的・物理的性質を持ち、リガンドとの結合を制御することで容易に操作することができる。リガンド(別の分子との結合を促進する分子)は、マンノースとして知られる糖である。ConAとマンノースの間の破断力を調べることは、病気の研究や新しい生物学的進歩の発見を促進するために利用できる。
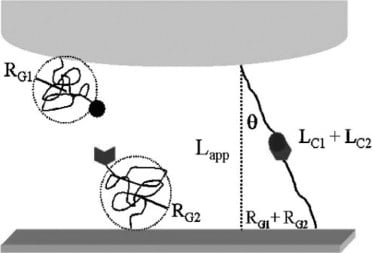
生体分子の非特異的結合を減らすために、力スペクトロスコピーが用いられた。分子をAFMカンチレバーに取り付け、基板表面を探った。カンチレバーのたわみを調べ、たわみの変化と結合破壊に必要な力を示した。結合の破断は、破断に近づくまでにポリマーが引き伸ばされる距離を計算することによって決定される。この実験では、結合種をポリマーテザーに付着させた。
シングルテザーシステムとは対照的に、研究者たちはダブルテザーシステムを適用した。ダブルテザリングシステムでは、タンパク質はAFMトップに、リガンドは金基板に結合する。局所的な特異的結合と非特異的結合を作り出すことで、非特異的結合の可能性を排除することができた。さらに、この方法により、力測定の全体的な精度が向上した。
窒化ケイ素カンチレバーは、ConAを含む緩衝液に浸す前に、AFM先端上の活性基の数を減らすために塩析した。次に、カモノハシ金でコーティングしたシリコン基板をエタノールに浸してSAMを作製し、マンノース溶液に浸した。こうして、マンノース官能基化基板を作製した。
次に、ConAタンパク質とマンノース基質との間のAFM測定を行った。接着相互作用として3つの長さスケールが同定された。
破断力は先端から基板までの距離によって決定された。上図のセクションCは、33mmと43mmの間のタンパク質とリガンドの相互作用を示す。この位置は、ConAとマンノース間のタンパク質-炭水化物結合の最初の切断を表している。この位置は長さが著しく伸びており、結合の切断を示している。結果は、タンパク質-リガンド結合阻害剤として機能するマンノースバッファーの添加でさらに確認された。先に示した33-43mm間の接着性相互作用は、ブロッキング剤の添加により減少したが、他の領域は影響を受けなかった。
結論として、AFM技術と 金メッキシリコン基板 は、非特異的結合を研究する際に心強い結果をもたらす。
リソース