Kraftspektroskopie bei der Bindung von Molekülen
Goldbeschichtete Siliziumsubstrate können die Anlagerung von Molekülen fördern und zu selbstorganisierten Monoschichten (SAMs) bei AFM-, Kraftspektroskopie- und Massenspektroskopie-Anwendungen führen. Die hohe Reinheit und Einheitlichkeit goldbeschichteter Substrate bieten die ideale Oberfläche für Charakterisierungsmethoden.
Eine Forschungsstudie, die an der University of California, Lawrence Livermore National Laboratory, durchgeführt wurde, untersuchte die Bindungsfähigkeiten eines Proteins und eines Liganden mit Hilfe der Rasterkraftmikroskopie (AFM) zusammen mit Polymer-Tethern. Platypus Technologies' goldbeschichtete Siliziumsubstrate wurden verwendet, um eine funktionalisierte Oberfläche zu schaffen, die die Untersuchung der Wechselwirkungen zwischen Proteinen und Liganden ermöglicht.
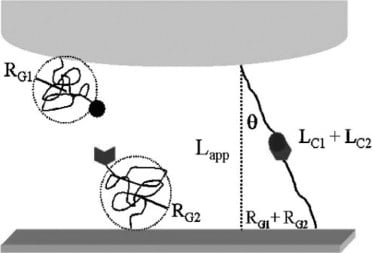
Die Bindungsbruchkraft wurde zwischen dem Protein Concanavalin-A (ConA) und Mannose untersucht. ConA wurde aufgrund seiner Rolle bei der Bindung von Kohlenhydraten für die Untersuchung ausgewählt. Kohlenhydratbindende Moleküle besitzen besondere chemische und physikalische Eigenschaften, die durch eine kontrollierte Bindung mit einem Liganden leicht manipuliert werden können. Als Ligand - ein Molekül, das die Bindung an ein anderes Molekül erleichtert - wurde ein Zucker namens Mannose ausgewählt. Die Untersuchung der Bruchkraft zwischen ConA und Mannose kann zur Erforschung von Krankheiten und zur Entdeckung neuer biologischer Fortschritte genutzt werden.
Die Kraftspektroskopie wurde eingesetzt, um die unspezifische Bindung von biologischen Molekülen zu verringern. Die Moleküle wurden an einem AFM-Cantilever befestigt, um die Substratoberfläche zu untersuchen. Die Auslenkung des Cantilevers wurde untersucht, um Änderungen in der Auslenkung und die für einen Bindungsbruch erforderliche Kraft zu ermitteln. Der Bindungsbruch wird durch die Berechnung der Strecke bestimmt, um die das Polymer gedehnt wird, bevor es reißt. In diesem Experiment wurden die Bindungsarten an Polymer-Tethern angebracht.
Im Gegensatz zu einem einfach angebundenen System verwendeten die Forscher ein doppeltes Anbindungssystem. Ein doppeltes Anbindungssystem ermöglichte es dem Protein, sich an die AFM-Oberseite und dem Liganden, sich an das Goldsubstrat zu binden. Die Schaffung einer lokalisierten spezifischen und unspezifischen Bindung half, die Möglichkeit einer unspezifischen Bindung auszuschließen. Darüber hinaus verbessert diese Methode die Gesamtgenauigkeit der Kraftmessungen.
Siliziumnitrid-Cantilever wurden versalzen, um die Anzahl der aktiven Gruppen auf der AFM-Spitze zu reduzieren, bevor sie in eine ConA-haltige Pufferlösung getaucht wurden. Mit Platypus-Gold beschichtete Siliziumsubstrate wurden anschließend in Ethanol getaucht, um SAMs zu erzeugen, die dann in die Mannose-Lösung getaucht wurden. Auf diese Weise entstand ein mit Mannose funktionalisiertes Substrat.
Anschließend wurden AFM-Messungen zwischen dem angebundenen ConA-Protein und dem Mannose-Substrat durchgeführt. Drei Längenskalen wurden als adhäsive Wechselwirkungen identifiziert.
Die Bruchkraft wurde durch den Abstand zwischen Spitze und Substrat bestimmt. Abschnitt C der obigen Abbildung veranschaulicht die Wechselwirkung zwischen Protein und Ligand zwischen 33 und 43 mm. Diese Stelle steht für den anfänglichen Bruch der Protein-Kohlenhydrat-Bindung zwischen ConA und Mannose. An dieser Stelle ist ein signifikanter Anstieg der Länge zu verzeichnen, was auf einen Bruch der Bindung hinweist. Die Ergebnisse wurden durch Zugabe eines Mannosepuffers, der als Inhibitor der Protein-Liganden-Bindung diente, weiter bestätigt. Die zuvor angezeigten adhäsiven Wechselwirkungen zwischen 33 und 43 mm wurden durch die Zugabe des Blockierungsmittels verringert, während andere Bereiche nicht betroffen waren.
Zusammenfassend lässt sich sagen, dass AFM-Techniken und goldbeschichtete Siliziumsubstrate kann bei der Untersuchung unspezifischer Bindungen ermutigende Ergebnisse liefern.
Ressourcen:
Kraftspektroskopie der doppelt verknüpften Concanavalin-A-Mannose-Bindung - ScienceDirect