Essais d'invasion cellulaire pour la recherche sur le cancer
L'invasion cellulaire à travers la membrane basale est une étape importante dans la métastase du cancer. Les métastases se produisent lorsque les cellules cancéreuses traversent la membrane basale de l'organe d'où elles proviennent et se répandent ensuite dans d'autres organes du corps, où elles forment des tumeurs secondaires.
L'invasion cellulaire à travers la membrane basale est une étape importante dans la métastase du cancer. Dans ce blog, nous discutons des tests d'invasion cellulaire et de leur application dans la recherche sur le cancer. Les métastases surviennent lorsque les cellules cancéreuses traversent la membrane basale de l'organe dont elles sont issues et se propagent ensuite dans d'autres organes du corps, où elles forment des tumeurs secondaires [1].
Les tests d'invasion cellulaire sont des outils importants pour la recherche sur le cancer. Les scientifiques qui étudient le cancer effectuent des essais d'invasion cellulaire pour mesurer le mouvement des cellules à travers une matrice extracellulaire. En modifiant les conditions de la culture cellulaire (par exemple en ajoutant de nouveaux médicaments), les scientifiques peuvent identifier les conditions qui empêchent ou accélèrent l'invasion cellulaire. Grâce à ces études, de nouveaux traitements contre le cancer peuvent être identifiés en vue d'une utilisation thérapeutique potentielle.
DES ESSAIS CELLULAIRES SIMPLES ET FIABLES POUR UNE SCIENCE DE POINTE
Afin d'accélérer les avancées scientifiques dans le domaine de la recherche sur le cancer, Platypus Technologies a introduit une plate-forme d'essai simple et reproductible pour étudier l'invasion cellulaire. L'essai OrisTM plateforme comprend des plaques à 96 puits avec des "bouchons" amovibles qui créent une zone centrale de détection sans cellules. Pour un essai d'invasion cellulaire, cette zone de détection peut être remplie d'une matrice extracellulaire au choix (par exemple, collagène, extrait de membrane basale (EMB), acide hyaluronique, hydrogels, etc.) Les cellules envahissent la matrice dans la zone de détection et l'étendue et le taux d'invasion cellulaire sont facilement quantifiés, en temps réel, à l'aide d'un lecteur de plaque ou d'images de microscope. Comparé à d'autres approches, le système OrisTM offre des avantages uniques pour l'étude de l'invasion cellulaire :
- Installation très simple et interprétation directe des données
- Identifier avec précision les médicaments ou les conditions spécifiques qui inhibent ou stimulent l'invasion cellulaire
- La zone de détection reproductible permet d'obtenir des résultats d'une grande précision
- Permet de mesurer l'invasion cellulaire en temps réel et au point final
- Une analyse facile :
- Utiliser l'OrisTM Masque de détection pour quantifier l'invasion à l'aide de lecteurs de plaques
- Vous faites de l'analyse d'images ? Aucune tache ni aucun masque n'est nécessaire
- Les résultats sont physiologiquement pertinents : les cellules pénètrent directement dans la matrice extracellulaire ; aucune membrane artificielle n'est nécessaire.
EXEMPLE D'ESSAI D'INVASION CELLULAIRE
Ci-dessous, une expérience illustre l'utilisation de l'OrisTM pour étudier l'invasion cellulaire à travers l'extrait de membrane basale (BME). Les principaux matériaux nécessaires à la réalisation de cet essai sont les suivants: (1) OrisTM essai de migration cellulaire enrobé de BME(2) solution BME, (3) cellules et (4) milieu de culture cellulaire. Les cellules de fibrosarcome HT1080 ont été colorées en direct et cultivées sur l'OrisTM recouvert de BME. Après une période d'incubation permettant la fixation des cellules, les bouchons qui créent la zone centrale de détection sans cellules ont été retirés et les puits de la plaque ont été remplis d'une solution de BME réfrigérée. Les cellules incluses dans le BME ont ensuite été incubées à 37 °C. Des images de la culture cellulaire ont été collectées à différents intervalles et analysées avec ImageJ.
[VOIR LE PROTOCOLE DÉTAILLÉ POUR ORISTM ESSAI DE MIGRATION CELLULAIRE]
La figure ci-dessous présente des images représentatives de la culture cellulaire avant le retrait des bouchons et après 40 heures d'incubation des cellules dans le BME.

Comme le montrent ces images, l'OrisTM a permis aux cellules de se fixer autour de la zone de détection circulaire exempte de cellules. Cette zone de détection, remplie de BME, facilite la caractérisation de l'invasion cellulaire : les cellules qui se déplacent dans la zone de détection circulaire peuvent être facilement quantifiées.
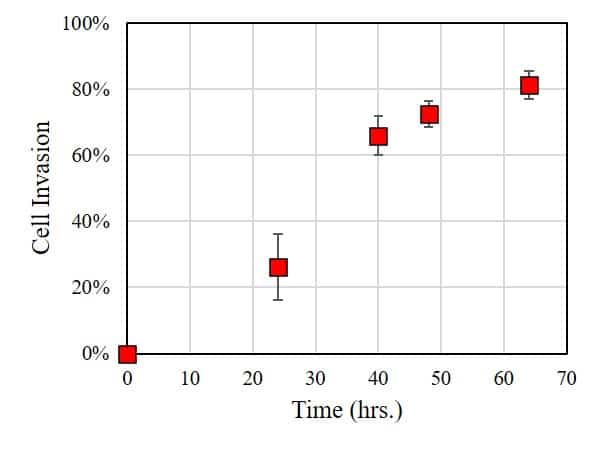
Dans ce cas, l'étendue de l'invasion cellulaire a été caractérisée en utilisant ImageJ pour mesurer la surface de la zone sans cellules : plus la surface est petite, plus l'étendue de l'invasion cellulaire dans le BME est importante. Comme le montre la figure ci-dessous, dans les 24 heures d'incubation, un nombre significatif de cellules a envahi la BME. Des temps d'incubation plus longs entraînent des taux d'invasion cellulaire nettement plus élevés.
CONCLUSION
Cette expérience démontre que HT1080 présente une invasion cellulaire significative dans la membrane basale. Des expériences complémentaires pourraient explorer les paramètres qui influencent l'invasion cellulaire, tels que (i) la rigidité de la membrane basale, (ii) les médicaments et leur concentration dans le milieu de culture, ou (iii) la présence d'une culture cellulaire secondaire (co-culture) dans la membrane basale. En conclusion, l'OrisTM constitue une plateforme simple et fiable pour réaliser des essais d'invasion cellulaire.
RÉFÉRENCES :
[1] T. A. Martin et al. "Cancer Invasion and Metastasis : Molecular and Cellular Perspective" In : Madame Curie Bioscience Database [Internet]. Austin (TX) : Landes Bioscience ; 2000-2013. LIEN
[2] M. Malboubi et al. "An open access microfluidic device for the study of the physical limits of cancer cell deformation during migration in confined environments" Microelectron. Eng. vol. 144, 16 août 2015 pp. 42-45. LIEN