Ensayos de invasión celular para la investigación del cáncer
La invasión celular a través de la membrana basal es un paso importante en la metástasis del cáncer. La metástasis se produce cuando las células cancerosas atraviesan la membrana basal del órgano en el que se originaron y posteriormente se diseminan por distintos órganos del cuerpo, donde forman tumores secundarios.
La invasión celular a través de la membrana basal es un paso importante en la metástasis del cáncer. En este blog hablamos de los ensayos de invasión celular y su aplicación en la investigación del cáncer. La metástasis se produce cuando las células cancerosas atraviesan la membrana basal del órgano en el que se originaron y posteriormente se diseminan a diferentes órganos del cuerpo, donde forman tumores secundarios [1].
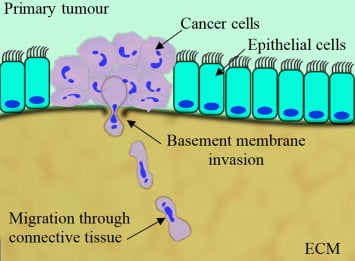
Los ensayos de invasión celular son herramientas importantes para la investigación del cáncer. Los científicos que estudian el cáncer realizan ensayos de invasión celular para medir el movimiento de las células a través de una matriz extracelular. Variando las condiciones del cultivo celular (por ejemplo, añadiendo nuevos fármacos), los científicos pueden identificar las condiciones que impiden o aceleran la invasión celular. Gracias a estos estudios, se pueden identificar nuevos tratamientos contra el cáncer para su posible uso terapéutico.
ENSAYOS CELULARES SENCILLOS Y FIABLES PARA AVANCES CIENTÍFICOS
Para acelerar los avances científicos en la investigación del cáncer, Platypus Technologies ha introducido una plataforma de ensayo sencilla y reproducible para estudiar la invasión celular. La plataforma OrisTM plataforma consta de placas de 96 pocillos con "tapones" extraíbles que crean una zona central de detección libre de células. Para un ensayo de invasión celular, esta zona de detección puede rellenarse con una matriz extracelular de elección (por ejemplo, colágeno, extracto de membrana basal (BME), ácido hialurónico, hidrogeles, etc.). Las células invaden la matriz en la zona de detección y el grado y la tasa de invasión celular se cuantifican fácilmente, en tiempo real, utilizando un lector de placas o a partir de imágenes de microscopio. En comparación con otros métodos, el sistema OrisTM ofrece ventajas únicas para el estudio de la invasión celular:
- Configuración muy sencilla e interpretación directa de los datos
- Identificar con precisión fármacos o condiciones específicas que inhiben o estimulan la invasión celular.
- La zona de detección reproducible permite obtener resultados de gran precisión
- Admite mediciones de la invasión celular en tiempo real y en el punto final.
- Análisis sencillo:
- Utiliza el OrisTM Máscara de detección para cuantificar la invasión mediante lectores de placas
- ¿Análisis de imágenes? No se necesitan tinciones ni máscaras
- Los resultados son fisiológicamente relevantes: las células invaden directamente la matriz extracelular; no se necesitan membranas artificiales.
EJEMPLO DE ENSAYO DE INVASIÓN CELULAR
A continuación, un experimento ilustra el uso del OrisTM para estudiar la invasión celular a través del extracto de membrana basal (BME). Los principales materiales necesarios para realizar este ensayo incluyen: (1) OrisTM ensayo de migración celular recubierto con BME(2) solución BME, (3) células y (4) medio de cultivo celular. Las células de fibrosarcoma HT1080 se tiñeron en vivo y se cultivaron en el OrisTM placa recubierta con BME. Tras un periodo de incubación para permitir la fijación de las células, se retiraron los tapones que crean la zona central de detección libre de células y se llenaron los pocillos de la placa con solución de BME refrigerada. Posteriormente, las células incrustadas en la BME se incubaron a 37 °C. Se recogieron imágenes del cultivo celular a varios intervalos y se analizaron con ImageJ.
[VÉASE EL PROTOCOLO DETALLADO PARA ORISTM ENSAYO DE MIGRACIÓN CELULAR]
La figura siguiente captura imágenes representativas del cultivo celular antes de retirar los tapones, y 40 horas de incubación de las células en BME.

Como se muestra en estas imágenes, el OrisTM permitió que las células se adhirieran alrededor de la zona de detección circular libre de células. Esta zona de detección, llena de BME, facilita la caracterización de la invasión celular: las células que se desplazan hacia la zona de detección circular pueden cuantificarse fácilmente.
En este caso, el grado de invasión celular se caracterizó utilizando ImageJ para medir el área de la zona libre de células: cuanto menor es el área, mayor es el grado de invasión celular en la BME. Como se muestra en la figura siguiente, a las 24 horas de incubación, un número significativo de células invadió la BME. A mayor tiempo de incubación, la tasa de invasión celular es significativamente mayor.
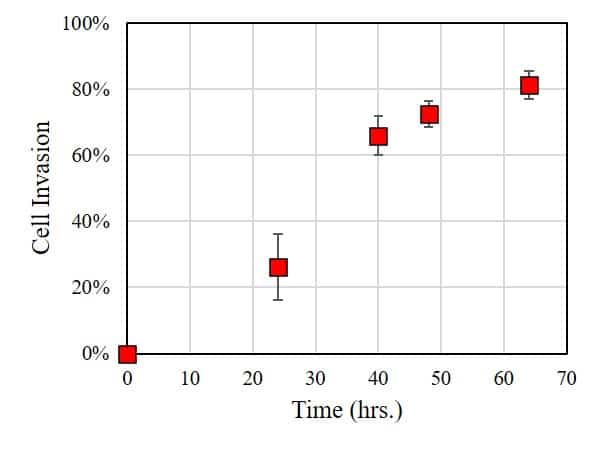
CONCLUSIÓN
Este experimento demuestra que HT1080 presenta una invasión celular significativa en la membrana basal. Los experimentos de seguimiento podrían explorar los parámetros que influyen en la invasión celular, como (i) la rigidez de la BME, (ii) los fármacos y la concentración de fármacos presentes en los medios de cultivo, o (iii) la presencia de cultivo celular secundario (co-cultivo) presente en la BME. En conclusión, el método OrisTM proporciona una plataforma sencilla y fiable para realizar ensayos de invasión celular.
REFERENCIAS:
[1] T. A. Martin et al. "Cancer Invasion and Metastasis : Molecular and Cellular Perspective" En: Madame Curie Bioscience Database [Internet]. Austin (TX): Landes Bioscience; 2000-2013. ENLACE
[2] M. Malboubi et al. "An open access microfluidic device for the study of the physical limits of cancer cell deformation during migration in confined environments" Microelectron. Eng. vol. 144, 16 ago. 2015 pp. 42-45. ENLACE