Zellinvasionsassays für die Krebsforschung
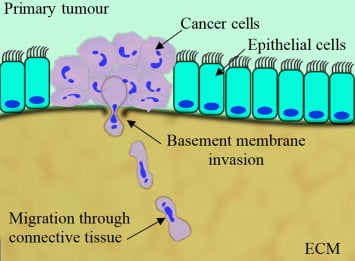
Das Eindringen von Zellen durch die Basalmembran ist ein wichtiger Schritt bei der Metastasierung von Krebs. Metastasen entstehen, wenn Krebszellen die Basalmembran des Organs, aus dem sie stammen, durchdringen und sich anschließend in anderen Organen des Körpers ausbreiten, wo sie sekundäre Tumore bilden
Die Invasion von Zellen durch die Basalmembran ist ein wichtiger Schritt bei der Metastasierung von Krebs. In diesem Blog erörtern wir Zellinvasionstests und ihre Anwendung in der Krebsforschung. Metastasen entstehen, wenn Krebszellen die Basalmembran des Organs, aus dem sie stammen, überwinden und sich anschließend in andere Organe des Körpers ausbreiten, wo sie sekundäre Tumore bilden [1].
Zellinvasionstests sind wichtige Instrumente für die Krebsforschung. Wissenschaftler, die sich mit Krebs beschäftigen, führen Zellinvasionstests durch, um die Bewegung der Zellen durch eine extrazelluläre Matrix zu messen. Durch Veränderung der Bedingungen in der Zellkultur (z. B. durch Zugabe neuer Medikamente) können Wissenschaftler Bedingungen ermitteln, die die Zellinvasion verhindern oder beschleunigen. Durch diese Studien können neue Krebsbehandlungen für den potenziellen therapeutischen Einsatz ermittelt werden.
EINFACHE & ZUVERLÄSSIGE ZELLTESTS FÜR BAHNBRECHENDE WISSENSCHAFT
Um wissenschaftliche Durchbrüche in der Krebsforschung zu beschleunigen, hat Platypus Technologies eine einfache, reproduzierbare Assay-Plattform zur Untersuchung der Zellinvasion eingeführt. Der OrisTM Plattform besteht aus 96-Well-Platten mit abnehmbaren "Stopfen", die eine zentrale zellfreie Detektionszone bilden. Für einen Zellinvasionstest kann diese Detektionszone mit einer extrazellulären Matrix nach Wahl (z. B. Kollagen, Basalmembran-Extrakt (BME), Hyaluronsäure, Hydrogelen usw.) gefüllt werden. Die Zellen dringen in die Matrix in der Detektionszone ein, und das Ausmaß und die Geschwindigkeit der Zellinvasion lassen sich leicht in Echtzeit mit einem Plattenlesegerät oder anhand von Mikroskopbildern quantifizieren. Im Vergleich zu anderen Ansätzen ist das OrisTM Plattform bietet einzigartige Vorteile für die Untersuchung der Zellinvasion:
- Sehr einfache Einrichtung und unkomplizierte Datenauswertung
- Genaue Identifizierung spezifischer Medikamente oder Bedingungen, die die Zellinvasion hemmen oder stimulieren
- Reproduzierbarer Erfassungsbereich ermöglicht hohe Genauigkeit der Ergebnisse
- Unterstützt Echtzeit- und Endpunktmessungen der Zellinvasion
- Einfache Analyse:
- Verwenden Sie die OrisTM Nachweismaske zur Quantifizierung der Invasion mit Plattenlesegeräten
- Führen Sie eine Bildanalyse durch? Keine Färbungen oder Masken erforderlich
- Die Ergebnisse sind physiologisch relevant: Die Zellen dringen direkt in die extrazelluläre Matrix ein; es werden keine künstlichen Membranen benötigt.
BEISPIEL EINES ZELLINVASIONSTESTS
Das folgende Experiment veranschaulicht die Verwendung des OrisTM Plattform zur Untersuchung der Zellinvasion durch Basalmembran-Extrakt (BME). Zu den wichtigsten Materialien, die zur Durchführung dieses Tests benötigt werden, gehören(1) OrisTM Zellmigrationstest, beschichtet mit BME(2) BME-Lösung, (3) Zellen und (4) Zellkulturmedien. HT1080-Fibrosarkomzellen wurden live gefärbt und auf dem OrisTM Platte, die mit BME beschichtet war. Nach einer Inkubationszeit, in der sich die Zellen anlagern konnten, wurden die Stopfen, die die zentrale zellfreie Nachweiszone bilden, entfernt und die Vertiefungen der Platte mit gekühlter BME-Lösung gefüllt. Anschließend wurden die in der BME eingebetteten Zellen bei 37 °C inkubiert. Die Bilder der Zellkultur wurden in verschiedenen Abständen aufgenommen und mit ImageJ analysiert.
[SIEHE AUSFÜHRLICHES PROTOKOLL FÜR ORISTM ZELLMIGRATIONS-ASSAY]
Die folgende Abbildung zeigt repräsentative Bilder der Zellkultur vor dem Entfernen der Stopfen und 40 Stunden nach der Bebrütung der Zellen in BME.

Wie auf diesen Abbildungen zu sehen ist, ist die OrisTM Plattform ermöglichte es den Zellen, sich um die kreisförmige zellfreie Detektionszone herum anzuheften. Diese mit BME gefüllte Detektionszone erleichtert die Charakterisierung der Zellinvasion: Zellen, die sich in die kreisförmige Detektionszone bewegen, können leicht quantifiziert werden.
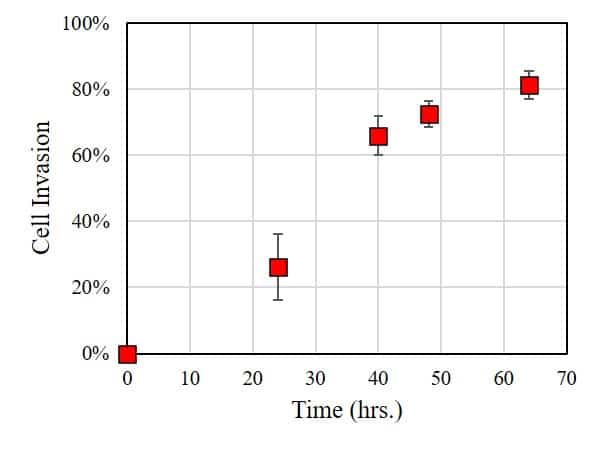
In diesem Fall wurde das Ausmaß der Zellinvasion durch die Verwendung von ImageJ charakterisiert, um die Fläche der zellfreien Zone zu messen: je kleiner die Fläche, desto größer das Ausmaß der Zellinvasion in die BME. Wie in der Abbildung unten zu sehen ist, ist innerhalb von 24 Stunden nach der Inkubation eine erhebliche Anzahl von Zellen in die BME eingedrungen. Längere Inkubationszeiten führen zu deutlich höheren Raten der Zellinvasion.
SCHLUSSFOLGERUNG
Dieses Experiment zeigt, dass HT1080 eine signifikante Zellinvasion in die Basalmembran aufweist. In Folgeexperimenten könnten Parameter untersucht werden, die die Zellinvasion beeinflussen, wie z. B. (i) die Steifigkeit der BME, (ii) die in den Kulturmedien vorhandenen Medikamente und deren Konzentration oder (iii) das Vorhandensein einer sekundären Zellkultur (Co-Kultur) in der BME. Zusammenfassend lässt sich sagen, dass die OrisTM Plattform bietet eine einfache und zuverlässige Plattform für die Durchführung von Zellinvasionstests.
REFERENZEN:
[1] T. A. Martin et al. "Cancer Invasion and Metastasis : Molecular and Cellular Perspective" In: Madame Curie Bioscience Database [Internet]. Austin (TX): Landes Bioscience; 2000-2013. LINK
[2] M. Malboubi et al. "An open access microfluidic device for the study of the physical limits of cancer cell deformation during migration in confined environments" Microelectron. Eng. vol. 144, 16 Aug. 2015 pp. 42-45. LINK