Die Geheimnisse der Alzheimer-Krankheit auf der Nanoskala entschlüsseln
Die Alzheimer-Krankheit (AD) ist eine schwächende neurodegenerative Erkrankung, von der weltweit Millionen von Menschen betroffen sind. Sie ist die Hauptursache für den kognitiven Abbau und den Tod bei Senioren und macht etwa 70% aller neurodegenerativen Erkrankungen aus. Eines der Kennzeichen der Alzheimer-Krankheit ist die Anhäufung von Amyloid-β-Proteinen (Aβ), die toxische Aggregate, die so genannten Amyloid-Plaques, bilden. Um die molekularen Mechanismen der Alzheimer-Krankheit besser zu verstehen und wirksame Behandlungen zu entwickeln, erforschen Forscher kontinuierlich neue Techniken zur Untersuchung dieser Proteine im Nanomaßstab.
A bahnbrechende Studie unter der Leitung eines internationalen Forscherteams hat eine neue Technik zum Nachweis von Aβ-Faltblattstrukturen in einzelnen Neuronen demonstriert, ohne dass eine Immunmarkierung erforderlich ist. Dieser innovative Ansatz, die so genannte scattering-type scanning near-field optical microscopy (s-SNOM), ermöglicht es den Wissenschaftlern, die Strukturen auf der Nanoskala zu analysieren und ein tieferes Verständnis der durch diese Aggregate verursachten Neurotoxizität zu gewinnen.
Amyloid-β-Proteine verstehen
Aβ-Proteine werden mit der Alzheimer-Krankheit in Verbindung gebracht, und ihre Ansammlung im Gehirn bildet Amyloid-Plaques, die für die Neuronen giftig sind. Die Forscher glauben, dass sie das Fortschreiten der Krankheit verlangsamen können, wenn sie diese Proteinaggregate beseitigen. Die derzeitigen Medikamente, die auf Aβ-Proteine abzielen, waren jedoch nicht wirksam, was darauf hindeutet, dass die molekularen Mechanismen der Aβ-Neurotoxizität nicht vollständig verstanden sind.
Herkömmliche Methoden zur Untersuchung dieser Proteine haben ihre Grenzen, wie z. B. eine unzureichende räumliche Auflösung oder die Notwendigkeit, die Struktur des angestrebten Epitops für die Markierung mit Fluorophoren vorher zu kennen. Um diese Herausforderungen zu überwinden, haben Forscher neue Spitzentechnologien wie s-SNOM entwickelt, die eine hochauflösende Bildgebung auf der Nanoskala ermöglichen.
Wie s-SNOM funktioniert
s-SNOM ist ein leistungsfähiges bildgebendes Verfahren, das Rasterkraftmikroskopie (AFM) und Infrarot-Spektralbildgebung (IR) kombiniert. Es ermöglicht Wissenschaftlern die Untersuchung von Amyloidstrukturen mit einer räumlichen Auflösung von 20-30 nm, was weit über das hinausgeht, was mit herkömmlichen Mikroskopietechniken erreicht werden kann. Diese bemerkenswerte Auflösung ermöglicht es den Forschern, molekulare Strukturen zu identifizieren und abzubilden, so dass sie die Proteinaggregation detaillierter untersuchen können.
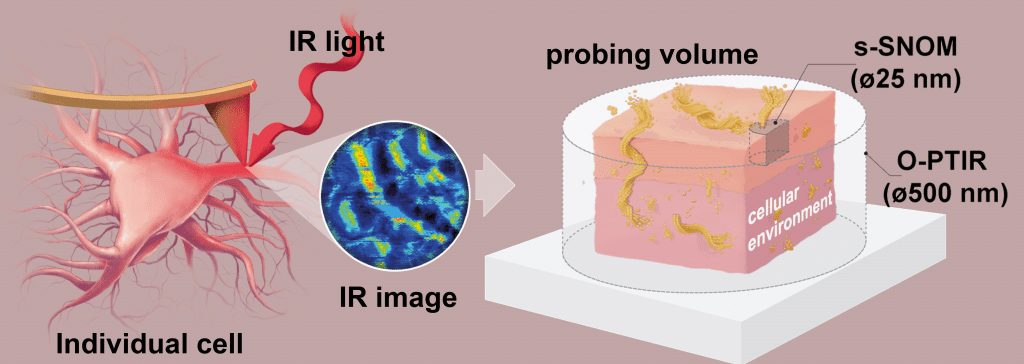
Die Rolle von ultraflachem Gold
In dieser Studie verwendeten die Forscher ultraflaches Gold von Platypus Technologies, um eine förderliche Umgebung für die hochauflösende Bildgebung von primären Neuronen zu schaffen. Die goldbeschichtete Oberfläche bot eine ideale Plattform für die Kultivierung der Neuronen und ermöglichte es den Forschern, die Aβ-Faltblattstrukturen direkt in einzelnen primären Neuronen mittels s-SNOM-Nanoimaging und Nano-FTIR-Messungen zu untersuchen.
Wichtige Erkenntnisse und künftige Auswirkungen
Diese bahnbrechende Forschungsarbeit zeigt das Potenzial von s-SNOM als wertvolles Instrument für Neurobiologen zur Untersuchung von Amyloidstrukturen im Nanomaßstab in Neuronen, ohne dass eine Immunmarkierung erforderlich ist. Die Verwendung von ultraflachem Gold von Platypus Technologies spielte eine entscheidende Rolle bei der Gewinnung hochauflösender Bilder und wertvoller Einblicke in die molekularen Mechanismen der Alzheimer-Krankheit.
Während wir weiterhin die Geheimnisse der Alzheimer-Krankheit entschlüsseln, können fortschrittliche Technologien wie s-SNOM in Verbindung mit hochwertigen Materialien wie ultraflachem Gold den Wissenschaftlern helfen, die der Krankheit zugrunde liegenden Mechanismen besser zu verstehen. Dieses Wissen könnte den Weg für wirksamere Behandlungen ebnen und letztlich das Leben von Millionen von Menschen, die von der Alzheimer-Krankheit betroffen sind, verbessern.