よくある質問 - オリス細胞遊走試験法
オリスアッセイは、細胞が通過しなければならない人工膜がないため、ボイデン/トランスウェルアッセイよりも生理学的により適切な環境を提供する。さらに、オリスアッセイでは顕微鏡観察の妨げとなる膜がないため、細胞の動きをリアルタイムでモニターすることができます。これはより多くの情報を提供するだけでなく、アッセイを観察するだけでエンドポイントが明らかになるため、メソッド開発を加速させます。
ボイデン/トランスウェルアッセイでは、細胞は2D表面に播種され、細胞生理を大きく変化させるが、オリス3D包埋浸潤アッセイは、アッセイを通して細胞が3Dに包埋されるため、細胞浸潤に関するボイデン/トランスウェルアッセイよりもさらに優れている(例えば、以下の文献を参照)。 1,2,3,4,5,6,7,8).
オリスの細胞遊走アッセイは細胞を傷つけません。さらに重要なことは、均一な無細胞検出領域により、スクラッチアッセイよりもはるかにロバストな統計が得られることである。 本書 そして このアプリケーションノート をイラストにした。
いいえ。プレートをご自身でコーティングされる場合は、オリスのユニバーサルセルマイグレーションアセンブリーキットをお勧めします。これらのキットにはプレートとストッパーが別々に梱包されています。お好きなようにプレートをコーティングし、実験開始直前にストッパーを挿入してください。
オリス マイグレーション、オリス インベイジョン、オリス プロ マイグレーション、オリス 3D Embedded Invasionアッセイは、ほとんどの接着細胞株で使用できるようにデザインされています。非付着細胞もオリス3D埋め込み浸潤アッセイに使用することができます。プラティパスではHT-1080、MDA-MB-231、PC3、HUVEC細胞を用いたオリス製品のテストを数多く成功させてきました。他の多くの細胞株も、お客様のようなお客様によってオリスと共に使用されています。 グーグル・スカラー で検索すると出てくる。
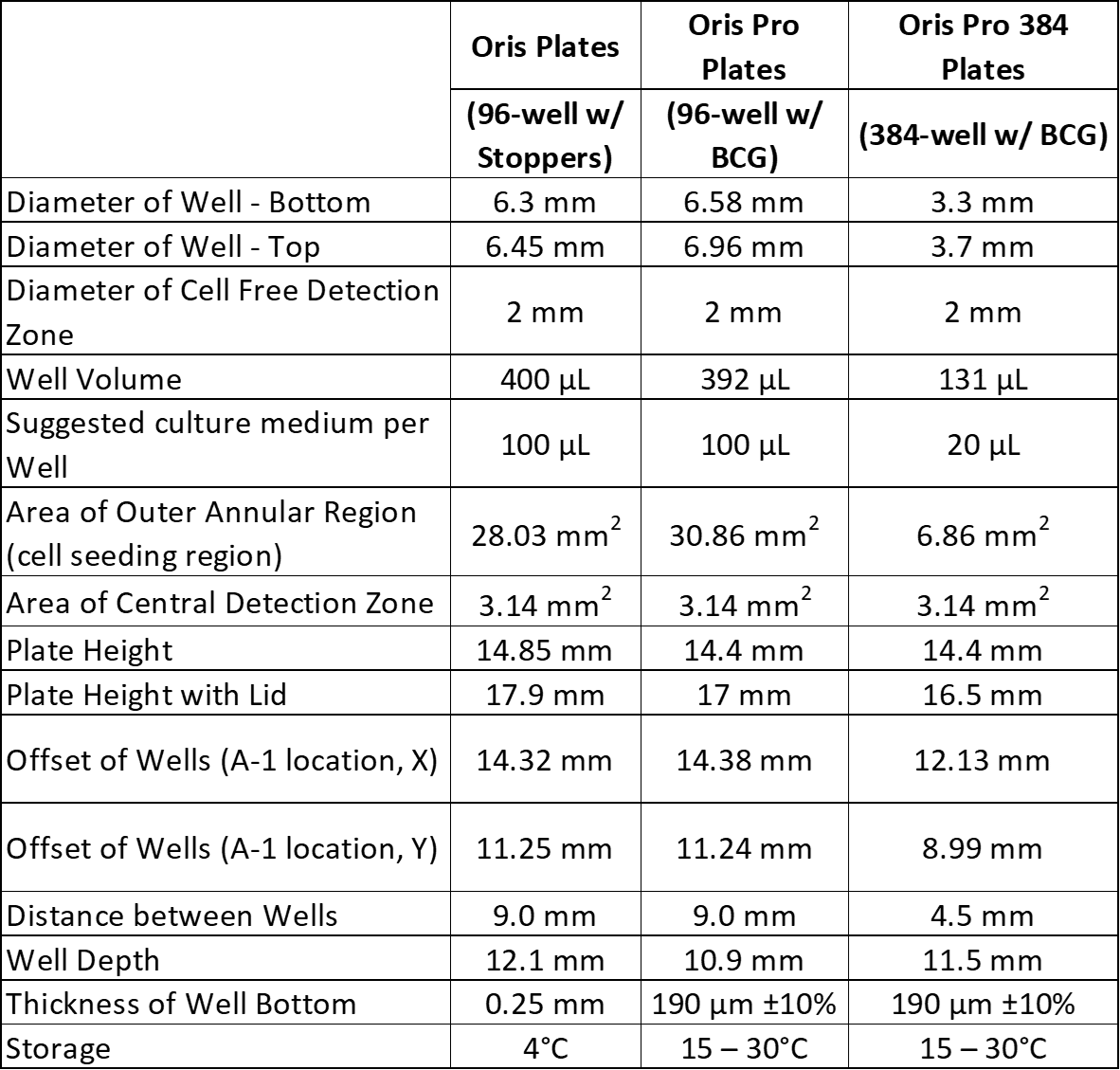
実験開始時に、細胞排除ゾーンの周囲に95-100%のコンフルエントな単 層ができるようにする。高い密度で播種すると、アッセイ開始時に検出ゾーンに 細胞が入る可能性があり、低い密度で播種すると、遊走後に検出 ゾーンに移動する細胞が少なくなります。通常、オリスおよびオリスプロ96ウェルプレートでは1ウェルあたり20,000~75,000個、オリスプロ384ウェルプレートでは1ウェルあたり2,500~10,000個の細胞を播種します。最初の実験では、Appendix 1に記載されているように、数種類の細胞播種密度をテストすることをお勧めします。 アッセイプロトコル.
オリスの3D 封入浸潤アッセイでは、ウェル当たり30,000 ~ 50,000個の細胞播種を推奨します。細胞株によっては、1ウェルあたり75,000 個もの細胞を播種する場合もありますが、多くの浸潤性細胞株はマトリックスメタロプロテアーゼを高濃度に発現しており、細胞密度が高いとコラーゲンが崩壊したり、液状化したりするほど分解されます。細胞数を減らせば、この問題は改善される。
最良の統計のためには、無処置細胞が検出ゾーンの元の開口部 の少なくとも2/3を閉鎖し、100%閉鎖以下になるアッセイ時間を選 択する。オリスCell Migration and Invasion Assaysの利点は、培養期間中いつでも細胞の移動量を確認できることです。初めてオリスアッセイを行う時は、定期的に顕微鏡で細胞を観察し、移動/浸潤の程度を評価し、適切な移動の程度が観察されたら実験を中止して下さい。
細胞の移動速度は細胞種によって大きく異なるので、最適な培養 時間は細胞種によって異なる。遊走時間は16~72時間、浸潤時間は1~6日である。長時間の実験には、48~72時間ごとに新しい阻害剤で培地を交換することを推奨する。
オリスのキットは1回の実験に使用するように構成されている。オリスの場合、再現性のある緊密な排除領域を形成する完璧な構造的適合を保つため、ストッパーは使用まで冷蔵保存する必要があります。OrisProの場合、インキュベーター内の湿度が未使用のウェルのゲルを水和させるため、その後の実験で排除帯のサイズとゲル溶解時間にばらつきが生じます。
1回の実験に必要なウェルの数が96ウェルより少ない場合は、96ウェルプレート4枚とストッパー24個入りが4パック入ったオリスのCell Migration Assembly Kit - FLEXをご検討ください。各プレートは1回のみ使用でき、ストッパーは4の倍数であればいくつでも使用できます。
ストッパーは、再現性のある緊密な排除領域を生み出す完璧な構造的適合を保つため、使用まで冷蔵保存する必要があります。37℃に長時間保たれたストッパーは適切にフィットせず、不規則でばらつきのある排除ゾーンになります。
適切に挿入されたストッパーの先端は、ウェルの底に雄牛の目のようなパターンを作ります。このブルズアイパターンを見るには、ストッパーを挿入した後にプレートを裏返し、斜めに傾けてください。透明な底面を通して、各ウェルの中央にこの雄の目パターンを見ることができます。うまく密封されなかったストッパーは、先端が適切に配置されるまで再度挿入することができます。
96ウェルプレートは「業界標準」ですが、ウェルの寸法はサプライヤーによって異なります。再現性のあるタイトバウンデッドゾーンを形成するためには、ストッパーが完全にフィットしていなければならないので、オリスプレートだけが適切に機能します。
まず、プレートを作業面にしっかりと当てて固定する。次に、ストッパーツールの下側をプレートの上面と平行に保ちながら、ストッパーツールのツメをストッパーストリップのバックボーン上部の間にスライドさせる。最後に、ストッパーツールを垂直に持ち上げ、ストッパーを静かに取り除く。ウェルからストッパーをこじ開けるためにストッパーツールをテコのように使用しないでください。この回答は役に立ちましたか?はい / いいえ
移動/侵入前の基準ウェルは、実験ウェルにおける移動の程度を定量化するために、検出ゾーンのサイズと位置を確定するために使用される。
オリスアッセイの場合、結果を読むまでストッパーをそのままにしておくことができます。オリスプロアッセイにはストッパーがないため、この方法は適用できません。
Oris ProおよびOrisアッセイでは、リファレンスウェルを確立するための代替方法があります:
マイグレーションが始まろうとしている時間ゼロに画像を収集するだけである。
アッセイの最初に、複製ウェルまたは複製プレートに固 定剤を加える。しかし、プレート内の一部のウェルに細胞を固定する場合、この方法では固定液の蒸気にさらされる可能性があるため、固定ウェルに隣接する細胞に影響を与えるリスクがあります。
アッセイを開始する際に、シトカラシンDのような遊走阻害剤または浸 潤阻害剤を参照ウェルに加える。細胞の移動が完全に阻害されるよう、十分な阻害剤を加えるようにしてください。
関連するアプリケーションノートもご参照ください。 ここにある。
オリスストッパーを取り外した後、またはオリスプロゲルを溶解した後、アッセイプレートが揺れた可能性があります。プレートを作業台からインキュベーターに移す際は注意してください。
細胞株のプレート表面への接着が悪い可能性がある。可能な解決策は以下の通りである:
TC処理プレートを使用した場合は、コラーゲンIまたはフィブロネクチンでコートしたプレートを試してみると、より接着が良くなる。
オリスアッセイを使用する場合は、培地を添加する前に細胞が接着する時間を長くとる。
オリス・プロ・アッセイを使用する場合は、細胞を播種する量を減らして、細胞がより早くプレート表面に到達するようにしてみてください。
細胞密度が高い場合は、播種する細胞を少なくして、全細胞が接着する機会を得るようにする。
Oris Stopper-Based Assaysの場合、細胞を播種した後、ストッパーを外す前にプレートを作業面に軽く叩き、細胞を均等に分散させます。
オリスアッセイでは、細胞が接着してストッパーを外した後、遊走が始まる前に試験化合物を培地に加える。
オリスプロアッセイでは、BCGが溶解して細胞が接着した後、遊走が始まる前に試験化合物を添加する。
オリスとオリスプロの両アッセイにおいて、接着時間は細胞株とプレートのコーティングに依存し、接着時間があります。接着していない細胞を除去するために、試験化合物を添加する前に培地を除去し、交換してもよい。浸潤アッセイでは、化合物をコラーゲンⅠ溶液に組み込んだり、コラーゲンの上の培地に添加したりすることができる。
選択肢はいくつかあるが、まずは最もシンプルなものから:
細胞倍加時間より短い時間でアッセイを行い、増殖を制限する。
2.遊走や浸潤を阻害しないアクチノマイシンDのような増殖阻害剤を加える。
増殖細胞のみに見られるマーカーである抗Ki67抗体で免疫染色し、結果からKi67陽性細胞を割り引く。
ビデオ顕微鏡でアッセイをモニターし、アッセイ中の各細胞の履歴を確認する。これは時間がかかり、高価な装置を必要とするデータ量の多いアプローチである。
特に位相差光学系があれば、染色しなくても明視野光学系で細胞は通常見える。しかし、染色は細胞を見やすくし、明視野光学系では不可能な生理学的状態を明らかにすることができます。オリスアッセイでは染色法の選択に制限はなく、必要に応じて複数の染色法を同時に使用することができます。
面積閉鎖による遊走/浸潤の定量には、検出器のシグナルを最大にするため、TRITC-ファロイジンなどの蛍光細胞質染色を推奨する。
細胞数をカウントして遊走/浸潤を定量化するには、DAPI のような核染色を推奨する。染色を核に限定することで、細胞質染色よりも撮影対象が小さくなり、個々の細胞間の分離がよくなるため、より正確な計数が可能になる。
オリスアッセイで播種する前に細胞をプレラベリン グすることも考えられる。しかしながら、染色によっては遊走や浸潤に影響を与え、実験的アーチファクトを引き起こす可能性がある。