用红外纳米光谱揭开阿尔茨海默氏症的分子秘密
阿尔茨海默氏症是一种以记忆力减退和认知功能障碍为特征的破坏性疾病,给患者及其家人带来巨大痛苦。阿尔茨海默氏症的主要病因之一是一种名为淀粉样蛋白-β(Aβ42)的蛋白质在大脑中聚集,形成有毒结构。科学家们一直在不懈努力,以了解这种疾病的分子基础,并开发能够阻止或逆转聚集过程的治疗方法。在一项 开创性研究研究人员利用红外纳米光谱和超扁平金探究了 Aβ42 聚集体与一种小分子抑制剂之间的相互作用。
红外纳米光谱:改变药物发现的游戏规则
红外纳米光谱学是一项尖端技术,它将原子力显微镜(AFM)与红外(IR)光谱学相结合,使科学家能够在纳米尺度上研究微小颗粒的结构和组成。这种强大的工具正在彻底改变我们研究复杂生物系统的方式,因为它可以提供有关单个分子及其相互作用的详细信息。
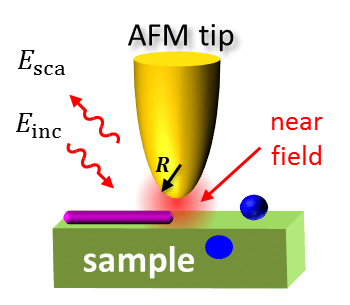
在这项研究中,研究人员利用红外纳米分光镜检查了小分子抑制剂贝沙罗汀对Aβ42聚集的影响。贝沙罗汀是美国食品及药物管理局批准的一种抗癌药物,在动物模型中已被证明能显著延缓Aβ42的聚集并降低其毒性。通过了解贝沙罗汀如何与 Aβ42 聚集体相互作用,科学家们希望开发出更有效的阿尔茨海默病治疗方法。
超扁平金:高分辨率成像的关键
为了得到最准确的结果,研究人员需要一种基质,使他们能够获得 Aβ42 聚集体及其与贝沙罗汀相互作用的高分辨率图像。这就是 超扁平金色 Platypus Technologies 公司的技术发挥了至关重要的作用。
超平金是一种专门设计的基底,表面极其光滑,是原子力显微镜等高分辨率成像技术的理想选择。通过使用超平金,科学家们获得了 Aβ42 聚集体的详细图像,揭示了它们的结构以及与贝沙罗汀相互作用的关键信息。
主要发现:贝沙罗汀如何与 Aβ42 聚集体相互作用
研究人员发现,贝沙罗汀通过涉及分子羧基的单氢键与 Aβ42 聚集体相互作用。这种相互作用对于抑制Aβ42的聚集至关重要,因为以甲酯基团代替羧基基团的贝沙罗汀衍生物没有显示出同样的抑制作用。这一发现凸显了了解潜在候选药物与其靶点之间精确分子相互作用的重要性。
阿尔茨海默病研究和治疗的未来
这项研究展示了红外纳米光谱和超扁平金在促进我们对阿尔茨海默氏症背后分子机制的了解方面所具有的巨大潜力。通过提供有关聚集蛋白和治疗化合物之间相互作用的详细信息,研究人员可以针对这种毁灭性疾病开发出更有针对性的有效治疗方法。
总之,红外纳米光谱和超平金技术正在改变阿尔茨海默氏症和其他蛋白质折叠错误疾病的药物发现领域。通过深入了解潜在疗法与其靶点之间的分子相互作用,这些尖端技术正在为更有效的疗法铺平道路,并最终为数百万患者及其家庭带来希望。