Spectroscopie de force dans la liaison des molécules
Les substrats de silicium recouverts d'or peuvent favoriser l'attachement des molécules et produire des monocouches auto-assemblées (SAM) dans les applications d'AFM, de spectroscopie de force et de spectroscopie de masse. La grande pureté et l'uniformité des substrats recouverts d'or en font la surface idéale pour les méthodes de caractérisation.
Une étude menée à l'Université de Californie, Lawrence Livermore National Laboratory, a étudié les capacités de liaison d'une protéine et d'un ligand en utilisant la microscopie à force atomique (AFM) ainsi que des câbles polymères. La technologie de Platypus Technologies substrats de silicium recouverts d'or ont été utilisés pour créer une surface fonctionnalisée permettant d'étudier les interactions entre les protéines et les ligands.
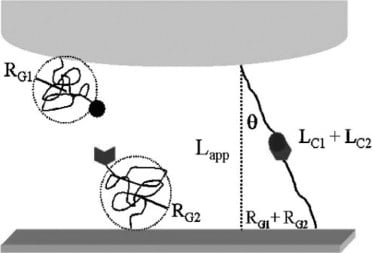
La force de rupture de la liaison a été étudiée entre la protéine concanavaline-A (ConA) et le mannose. La ConA a été choisie pour l'évaluation en raison de son rôle dans la liaison aux hydrates de carbone. Les molécules liant les hydrates de carbone possèdent des propriétés chimiques et physiques distinctes qui peuvent être facilement manipulées par une liaison contrôlée avec un ligand. Le ligand, une molécule qui facilite la liaison à une autre molécule, sélectionné pour la liaison était un sucre connu sous le nom de mannose. L'étude de la force de rupture entre la ConA et le mannose peut être utilisée pour étudier les maladies et promouvoir la découverte de nouvelles avancées biologiques.
La spectroscopie de force a été utilisée pour réduire la liaison non spécifique des molécules biologiques. Des molécules ont été attachées à un cantilever AFM afin de sonder la surface du substrat. La déflexion du cantilever a été examinée afin d'indiquer les changements de déflexion et la force nécessaire pour créer une rupture de liaison. La rupture de la liaison est déterminée en calculant la distance à laquelle le polymère est étiré avant de s'approcher de la rupture. Dans cette expérience, les espèces de liaison ont été attachées à des câbles en polymère.
Au lieu d'un système à attache simple, les chercheurs ont appliqué un système à double attache. Ce système permet à la protéine de se fixer sur le sommet de l'AFM et au ligand de se fixer sur le substrat d'or. La création d'une liaison spécifique et non spécifique localisée a permis d'éliminer la possibilité d'une liaison non spécifique. En outre, cette méthode améliore la précision globale des mesures de force.
Les cantilevers en nitrure de silicium ont été salinisés pour réduire le nombre de groupes actifs sur la pointe AFM avant d'être immergés dans une solution tampon contenant du ConA. Les substrats de silicium recouverts d'or de Platypus ont ensuite été immergés dans de l'éthanol pour produire des SAM qui ont ensuite été immergés dans la solution de mannose. On obtient ainsi un substrat fonctionnalisé au mannose.
Des mesures AFM ont ensuite été effectuées entre la protéine ConA attachée et le substrat de mannose. Trois échelles de longueur ont été identifiées comme étant des interactions adhésives.
La force de rupture a été déterminée par la distance entre la pointe et le substrat. La section C de la figure ci-dessus illustre l'interaction entre la protéine et le ligand entre 33 et 43 mm. Cet endroit représente la rupture initiale de la liaison protéine-glucide entre la ConA et le mannose. Cet endroit présente une augmentation significative de la longueur, indiquant la rupture de la liaison. Les résultats ont été confirmés par l'ajout d'un tampon de mannose qui a servi d'inhibiteur de la liaison protéine-ligand. Les interactions adhésives précédemment indiquées entre 33 et 43 mm ont été réduites par l'ajout de l'agent bloquant, alors que les autres régions n'ont pas été affectées.
En conclusion, les techniques AFM et substrats de silicium recouverts d'or peut fournir des résultats encourageants lors de l'étude de la liaison non spécifique.
Ressources :
Spectroscopie de force de la liaison mannose de la Concanavaline-A à double attache - ScienceDirect